As misturas homogêneas de duas ou mais substâncias são denominadas soluções. Um exemplo ilustrativo é a adição de uma pequena quantidade de açúcar em um copo contendo água. Em questão de segundos, é possível observar a completa dissolução do açúcar, resultando em uma mistura uniforme, ou seja, uma solução. Nesse caso, o açúcar é denominado soluto, por estar presente em menor quantidade, enquanto a água é o solvente, por ser o componente majoritário na mistura.

Era uma vez um jovem estudante de química, chamado Lucas, que estava tendo dificuldades para entender o conceito de soluções em suas aulas. De fato, sabia que soluções no vestibular é um tema recorrente. Ele não conseguia entender como duas substâncias podiam se misturar de forma uniforme e como a adição de uma substância em outra poderia criar uma solução.
Em uma tarde ensolarada, Lucas decidiu experimentar por si mesmo e preparou um copo de água com açúcar. Ele adicionou uma pequena quantidade de açúcar na água e ficou observando enquanto a substância se dissolvia completamente, formando uma solução transparente.
Lucas ficou surpreso ao ver a água e o açúcar se unirem para criar uma mistura uniforme, sem deixar resíduos ou sedimentos. Ele percebeu que o açúcar era o soluto, por estar em menor quantidade, e a água era o solvente, por ser o componente majoritário na mistura.
A partir daquele momento, Lucas entendeu o conceito de soluções e conseguiu aplicá-lo em suas aulas de química. Ele aprendeu que a mistura homogênea de duas ou mais substâncias é chamada de solução e que ela pode ser encontrada em vários aspectos do nosso cotidiano, desde uma xícara de café com açúcar até a fórmula de um medicamento.

Por definição, podemos entender que o solvente é a substância responsável por dissolver o soluto. Isso significa que quando consumimos uma limonada, por exemplo, estamos ingerindo uma solução em que as substâncias presentes na polpa do limão são consideradas soluto e a água é o solvente.
A água é comumente utilizada como solvente na maioria das soluções, o que a torna conhecida como o solvente universal. Dessa forma, podemos definir soluto como o componente que é dissolvido no solvente e que normalmente se encontra em menor quantidade, enquanto o solvente é o componente que dissolve o soluto e, geralmente, está presente em maior quantidade na mistura.
A uniformidade das soluções é atribuída, em parte, ao tamanho das partículas presentes, que têm um diâmetro médio de cerca de 1 nanômetro (1 nanômetro = 10-9 m). Este é um tamanho excepcionalmente pequeno em comparação com os diversos materiais que encontramos em nosso cotidiano. É importante notar que, se as partículas são muito pequenas, não é possível enxergá-las a olho nu ou mesmo com o auxílio de um ultramicroscópio.
Devido a isso, não conseguimos distinguir uma solução, como a água do mar, de uma substância pura, como a água destilada. Dessa forma, dizemos que uma solução com essas características é um sistema homogêneo, no qual apenas uma fase pode ser observada.

Existem três tipos de soluções: sólidas, líquidas e gasosas, que dependem do estado físico de seus componentes. A seguir, estudaremos cada uma dessas particularidades.
Soluções sólidas são compostas por constituintes na fase sólida, como as ligas metálicas. Um exemplo é o bronze, uma liga metálica de cobre (Cu) e estanho (Sn), utilizado para confeccionar os sinos das igrejas. O latão, constituído de cobre (Cu) e zinco (Zn), também é um exemplo de solução sólida. O aço inoxidável, muito utilizado na construção civil e em objetos domésticos, como panelas e talheres, também se encaixa nessa definição.
Tem se também as soluções líquidas apresentam o solvente na fase líquida, como a cerveja, que contém aproximadamente 4% de álcool etílico em volume. O mar é um exemplo de solução líquida complexa, pois contém centenas de sais dissolvidos. Já os refrigerantes e outras bebidas gaseificadas são exemplos de soluções líquidas com gases dissolvidos.
A solução gasosa é caracterizada por seus constituintes estarem na fase gasosa. Um exemplo é o gás de cozinha, composto principalmente por hidrocarbonetos como propano e butano, e que é utilizado para cozinhar alimentos. Quando queimados com o gás oxigênio (O2), esses gases liberam energia para a preparação dos alimentos.
Outro exemplo de solução gasosa é o ar atmosférico ao nosso redor, que é uma mistura de gases como nitrogênio (N2), oxigênio (O2), dióxido de carbono (CO2), entre outros.
Há muito tempo atrás, havia um reino governado pelo rei Soluções. O rei sempre se preocupou com a qualidade das soluções que eram produzidas em seu reino, e queria que todos soubessem sobre os diferentes tipos de soluções que existiam. Ele decidiu que todos os jovens deveriam ser educados sobre o assunto.
O rei convidou um sábio para ensinar os jovens sobre as três principais soluções: sólidas, líquidas e gasosas. O sábio começou a explicar que cada tipo de solução tinha seus próprios constituintes e estados físicos.
Ele mostrou aos jovens como as soluções sólidas eram compostas por constituintes na fase sólida, como o bronze e o latão. Ele também explicou que o aço inoxidável, um material muito utilizado na construção civil e em objetos domésticos, também era um exemplo de solução sólida.
QUESTÕES – CONCENTRAÇÕES – SOLUÇÕES NO VESTIBULAR
Realizar questões sobre o estudo de soluções químicas é fundamental para o entendimento e aprofundamento nessa área da Química. Isso ocorre por diversos motivos:
– Fixação do conteúdo: Ao realizar as questões, o estudante pode revisar e fixar conceitos fundamentais relacionados a soluções químicas, como concentração, solubilidade, propriedades coligativas, equilíbrio químico, entre outros.
– Identificação de erros conceituais: Ao resolver questões, o estudante pode identificar erros conceituais e saná-los. Isso é especialmente importante em Química, onde muitos conceitos são interligados e a compreensão de um deles pode ser fundamental para a resolução de outros.
– Preparação para avaliações: A resolução de questões de soluções químicas é uma excelente forma de preparação para avaliações, seja ela um teste em sala de aula ou um exame vestibular. As questões permitem que o estudante se familiarize com o tipo de questões e nível de dificuldade que será cobrado na prova.
– Desenvolvimento de habilidades: Resolver questões de soluções químicas é uma excelente forma de desenvolver habilidades como raciocínio lógico, interpretação de texto, análise de dados, entre outras. Essas habilidades são importantes não apenas na Química, mas também em outras áreas do conhecimento e no cotidiano.
Soluções nos vestibulares e ENEM nos últimos três anos (2023-2021)
O tema soluções é um assunto comum em provas de química nos vestibulares, veja as estatísticas.
- ENEM 4%
- FUVEST 20%
- ITA 12%
- UNESP 19%
- UNICAMP 30%
- UNIFESP 23%
1. (UFSC 2023)
Notícias de acidentes com produtos químicos infelizmente são recorrentes nos noticiários. Esses acidentes causam, muitas vezes, impactos ao meio ambiente e à saúde dos que estão próximos ao evento. Em julho de 2022 ocorreu um acidente com um caminhão que transportava, entre outros produtos, etanol 70% e 90%, em massa.
Disponível em: https://g1.globo.com/sp/ribeirao-preto-franca/noticia/2022/07/27/caminhao-carregado-com-produtos-quimicos-tomba-e-interdita-acesso-a-avenida-na-zona-leste-de-ribeirao-preto-sp.ghtml Acesso em: 14 set. 2022.
Sobre o assunto, é correto afirmar que:
01) o etanol 70%, comercializado como “álcool 70” e amplamente usado para sanitização durante a pandemia de covid-19, possui 70% em massa de etanol e 30% em massa de água.
02) os valores 70% e 90% estão relacionados com a massa molar do álcool utilizado.
04) o etanol produzido no Brasil é um biocombustível originado de vegetais, como a cana-de-açúcar.
08) a neutralização do derramamento com uma solução aquosa de detergente não seria efetiva, porque a solubilidade do etanol em água é limitada e haveria precipitação do álcool.
16) o etanol 70% é um líquido inflamável que está sujeito à combustão devido à presença de água, que é um comburente, e ao calor produzido pela irradiação solar no local do acidente.
2. (UNIFESP 2023)
De acordo com a resolução 430/2011 do Conselho Nacional do Meio Ambiente (CONAMA), o valor máximo (VM) da concentração de íons bário em efluentes é de 5,0 mg/L. Um meio de remover íons Ba2+ desses efluentes é precipitá-los sob a forma de sulfato de bário (BaSO4). Dado: Ba = 137 g/mol.
Expresse o VM da concentração de íons bário em g/L e em mol/L.
3. (UPF 2023)
A cachaça é uma bebida alcoólica típica brasileira, sua constituição é controlada por legislação do Ministério da Agricultura, Pecuária e Abastecimento (MAPA). Seu teor alcoólico em álcool etílico (C2H5OH) é de 35% a 45% (v/v). Dentre os contaminantes controlados estão os íons cobre, provenientes de alambiques construídos de metal e que podem estar na composição da bebida preferida dos brasileiros em valores máximos de 5 mg/L.
(Fonte: https://www.cachacadesabor.com.br/alambique-de-cobre/).
Com base nessas informações, avalie as afirmações a seguir sobre a fabricação e o controle de qualidade das cachaças nacionais, identificando-as como verdadeiras (V) ou falsas (F):
( ) Um alambique produz a cachaça por processo de destilação a partir de mosto fermentado de caldo de cana de açúcar.
( ) O máximo permitido de concentração de íons cobre em um copo de 150 mL de cachaça é de aproximadamente 0,75 g.
( ) O máximo permitido de quantidade de matéria de íons cobre em um copo de 150 mL de cachaça é de aproximadamente 0,635 mols.
( ) O teor alcoólico em álcool etílico em uma cachaça é de 40% (v/v); em 500 mL dessa amostra, tem-se uma concentração de aproximadamente 9,68 mol/L de etanol.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Dados: C = 12g/mol; H = 1g/mol; O = 16g/mol; d C2H5OH = 0,8 g/mL.
a) V – F – F – F.
b) F – V – F – V.
c) V – F – V – V.
d) F – V – F – F.
e) V – F – V – F.
4. (PUCRS Medicina 2023)
O álcool em gel recomendado para higienização das mãos no combate ao coronavírus SARS-CoV-2 é constituído essencialmente por álcool etílico, água e agentes espessantes para dar a consistência do produto. Para que atue como antisséptico, o álcool em gel deve apresentar uma concentração em álcool etílico (CH3CH2OH) de 70% m/m. Sabendo que a densidade do álcool etílico é 0,789 g mL–1, a concentração em mol L–1 desse composto é, aproximadamente,
Dados: C = 12; H = 1; O = 16
a) 0,012
b) 0,12
c) 1,2
d) 12
5. (UNICAMP 2023)
Um artigo científico relata a construção e a eficiência de um reator fotocatalítico de fluxo contínuo para a degradação de hormônios presentes em águas tratadas para consumo humano. Num trecho desse estudo, os autores afirmam: “é interessante notar que 80% de estrogênio foram removidos numa alimentação a 200 ng/L, 25 mW/cm2 e 300 L/(m2 h), enquanto que as remoções de progesterona e testosterona ficaram em 44% e 33%, respectivamente”.
De acordo com essas informações, pode-se inferir que o reator é capaz de degradar
a) dois hormônios femininos e um masculino, sendo que degrada melhor um feminino.
b) dois hormônios femininos e um masculino, sendo que degrada melhor o masculino.
c) somente hormônios masculinos, sendo que degrada melhor o estrogênio.
d) somente hormônios femininos, sendo que degrada melhor o estrogênio.
6. (UNESP 2023)
No Brasil, enfatiza-se que o Valor Máximo Permitido (VMP), destacado na portaria MS no 2.914/2011, que dispõe sobre normas e padrão de potabilidade da água para consumo humano, relacionado com os fluoretos, é de 1,5 mg de F− por litro de água.
(Fundação Nacional de Saúde. Manual de fluoretação da água para consumo humano, 2012. Adaptado.)
Uma Estação de Tratamento de Água (ETA), que utiliza o fluoreto de sódio (NaF) como único fluoreto, trata 100 milhões de litros de água por dia. Assim, a massa máxima de NaF que essa ETA deve utilizar por dia é próxima de
Dados: Na = 23; F = 19.
a) 220 kg.
b) 330 kg.
c) 110 kg.
d) 440 kg.
e) 550 kg.
7. (FUVEST 2023)
Combustíveis fósseis, como o diesel, contém em sua composição uma fração de enxofre. Durante o processo de combustão, o enxofre é convertido em SO2, tornando-se um poluente ambiental. Em postos de combustível, normalmente são comercializados dois tipos de diesel, o Diesel S10 e o Diesel S500. O primeiro contém 10 ppm de enxofre, e o segundo, 500 ppm de enxofre.
Considere que na combustão do diesel, todo enxofre seja convertido em SO2, conforme reação a seguir:
S(s) + O2(g) –> SO2(g)
Nesse caso, a diferença de massa de SO2 emitido para a atmosfera por kg de diesel quando cada um dos dois tipos é queimado é de
Note e adote:
Massas molares (g/mol): O = 16; S = 32.
1 ppm de enxofre equivale a 1 mg de enxofre por kg de diesel
a) 245 mg/Kg
b) 490 mg/Kg
c) 980 mg/Kg
d) 1960 mg/Kg
e) 3920 mg/Kg
8. (UNIFOR – Medicina 2023)
Para se determinar o teor de ácido acetil salicílico (C9H8O4) num comprimido analgésico, 1,0 g de comprimido foi dissolvido em 40,0 mL de etanol. Essa solução consumiu 20,0 mL de uma solução aquosa de NaOH 0,25 mol/L para a reação completa de acordo com a seguinte reação:
C9H8O4(aq) + NaOH (aq) –> NaC9H7O4(aq)
Logo o teor, em massa, de ácido acetil salicílico será de:
Dados: C = 12; H = 1; O = 16.
a) 55,0%
b) 67,0%
c) 80,0%
d) 90%
e) 97,0%
9. (FCMSCSP 2023)
A nitroglicerina (C3H5N3O9) é uma medicação empregada na forma injetável em diversas terapias cardiológicas. Ela é disponibilizada para uso hospitalar em ampolas de 10 mL, em solução com concentração 5 mg/mL.
Para uso intravenoso, deve-se preparar uma infusão com diluição de uma ampola de nitroglicerina em soro fisiológico até o volume final de 500 mL.
Nessa solução para infusão, a concentração de nitroglicerina é igual a
a) 1 g/L.
b) 0,1 g/L.
c) 0,05 g/L.
d) 0,5 g/L.
e) 0,01 g/L.
10. (FUVEST 2023)
O gráfico mostra a quantidade de emissão de CO2 (em bilhões de toneladas) em função do ano.

O total de emissão de CO2, em bilhões de toneladas, entre os anos de 1950 e 1990, está entre
a) 1 e 5.
b) 5 e 100.
c) 100 e 300.
d) 300 e 800.
e) 800 e 1000.
11. (UFPR 2023)
A elevação da concentração de fosfato em rios e lagos causa poluição e outros problemas ambientais, como a eutrofização. Assim, o monitoramento da concentração de fosfato é de interesse ambiental e pode ser realizado por meio de teste colorimétrico, explorando a reação de azul de molibdênio. Ao adicionar o íon molibdato (MoO42-), ácido mineral e um agente redutor numa amostra de água contendo fosfato, forma-se o composto de intensa cor azul. A intensidade de cor da solução neste teste é proporcional à concentração de fosfato na amostra.
O gráfico de barras a seguir mostra a relação da intensidade de cor observada para uma amostra de 10 mL em função da concentração de fosfato.
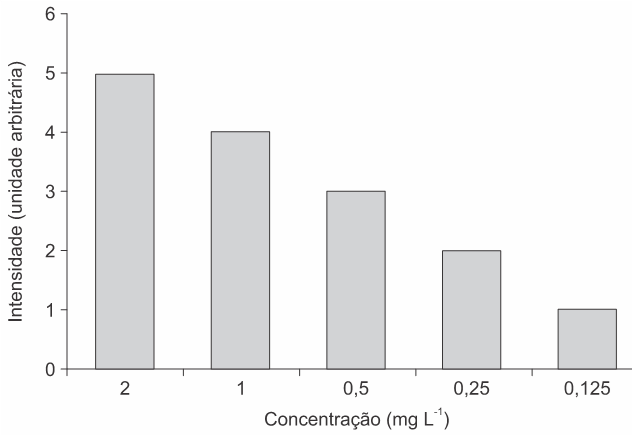
Uma amostra de 2 mL da água de um rio foi misturada com 8 mL de água pura (destilada) de modo a produzir 10 mL de solução. Essa solução foi submetida ao teste com azul de molibdênio que forneceu o resultado de intensidade de cor igual a 3 unidades arbitrárias. O valor de concentração de fosfato na água desse rio é mais próximo de:
a) 2,5 mg L-1.
b) 2,0 mg L-1.
c) 1,0 mg L-1.
d) 0,2 mg L-1.
e) 0,1 mg L-1.
12. (PUCCAMP 2023)
Medicamentos poluem rios em todos os continentes
Analgésicos, antidepressivos, antialérgicos e anti-hipertensivos podem ser encontrados não só em farmácias e hospitais, mas também em rios do mundo inteiro. Um grupo de 127 pesquisadores de 86 centros de pesquisa, incluindo brasileiros, encontrou resíduos de 73 fármacos em amostras de água de 1.052 locais em 258 rios de todos os continentes. Cerca de 470 milhões de pessoas vivem próximas aos locais em que foram examinadas as amostras de água. Os compostos químicos encontrados nas concentrações mais elevadas foram o analgésico paracetamol, o estimulante cafeína, o antidiabético metformina, o antialérgico fexofenadina, os antibióticos sulfametoxazol e metronidazol e o anticonvulsivante gabapentina. Rios de países pobres na Ásia, África e América do Sul foram os mais poluídos. A maior concentração encontrada (227 microgramas por litro) foi de paracetamol em um ponto de coleta no rio Seke próximo a um depósito de lixo e despejo de esgoto em La Paz, na Bolívia. (PNAS, 14 de fevereiro).
(Adaptado de: Revista Pesquisa Fapesp, junho de 2022, p. 16)
A maior concentração encontrada do paracetamol corresponde à concentração, em mol/L, de, aproximadamente,
Dados:
Massas moleculares (g/mol) H = 1,0; C = 12,0; N = 14,0 e O = 16,0 .
a) 1,5 x 10-4
b) 4,5 x 10-3
c) 3,2 x 10-4
d) 1,5 x 10-6
e) 4,5 x 10-5
13. (FAMEMA 2022)
Uma pastilha efervescente de antiácido estomacal contém, em sua composição, 1680mg de bicarbonato de sódio (NaHCO3) e 960mg de ácido cítrico (C6H8O7).
I) Determine o volume máximo de CO2 que pode ser liberado na reação completa do bicarbonato de sódio quando uma pastilha do antiácido é colocada em água. Considere que o volume molar nas condições da reação seja de 24L.
II) Considerando a quantidade de ácido cítrico contida numa pastilha do antiácido, determine a concentração, em mol/L no preparo de 500mL de solução aquosa desse ácido.
Dados: H = 1; C = 12; O = 16; Na = 23.
14. (ENEM 2022)
O ácido tartárico é o principal ácido do vinho e está diretamente relacionado com sua qualidade. Na avaliação de um vinho branco em produção, uma analista neutralizou uma alíquota de 25,0 mL do vinho com NaOH a 0,10 mol L–1, consumindo um volume igual a 8,0 mL dessa base. A reação para esse processo de titulação representada pela equação química:

A concentração de ácido tartárico no vinho analisado é mais próxima de:
a) 1,8 g L–1
b) 2,4 g L–1
c) 3,6 g L–1
d) 4,8 g L–1
e) 9,6 g L–1
GABARITO
Questão 1: Certas 01 + 04 = 05
Questão 2: 5 x 10-3 g/L e 3,65 x 10-5 mol/L
Questão 3: [A]
Questão 4: [D]
Questão 5: [A]
Questão 6: [B]
Questão 7: [C]
Questão 8: [D]
Questão 9: [B]
Questão 10: [D]
Questão 11: [A]
Questão 12: [D]
Questão 13: VCO2 = 0,489 L e [C6H8O7] = 0,01 mol/L
Questão 14: [B]
Sugestões de vídeos:



