Você provavelmente já usou pilhas em algum momento da sua vida. Seja para alimentar o controle remoto da TV, o relógio de parede ou até mesmo os brinquedos das crianças, as pilhas são essenciais para fornecer energia portátil de forma prática e conveniente. Mas você já parou para pensar como elas funcionam? Neste artigo, vamos explorar o conceito da química por trás das pilhas e descobrir como elas transformam reações químicas em eletricidade.
O que são pilhas?
As pilhas, também conhecidas como baterias primárias, são dispositivos eletroquímicos que convertem energia química em energia elétrica. Elas são compostas por dois eletrodos (um ânodo e um cátodo) separados por um eletrólito. Esses componentes interagem de forma a produzir uma corrente elétrica.
Funcionamento das pilhas:
Quando uma pilha é ativada, ocorrem reações químicas nos eletrodos. No ânodo, ocorre uma oxidação, onde átomos ou íons são convertidos em íons positivos, liberando elétrons. No cátodo, ocorre uma redução, onde os íons positivos do eletrólito são reduzidos e combinados com os elétrons provenientes do ânodo. Essas reações geram um fluxo de elétrons, criando uma corrente elétrica que pode ser utilizada para alimentar dispositivos eletrônicos.
Tipos de pilhas:
Existem diferentes tipos de pilhas disponíveis no mercado, cada uma com características e aplicações específicas. As pilhas alcalinas são comumente usadas em dispositivos de baixa potência, como controles remotos e relógios. Já as pilhas de lítio são mais adequadas para dispositivos de alta potência, como câmeras digitais e smartphones. Além disso, há também as pilhas recarregáveis, como as pilhas de íons de lítio, que podem ser reutilizadas diversas vezes, reduzindo o impacto ambiental.
Impacto Ambiental e reciclagem:
É importante lembrar que as pilhas contêm substâncias químicas que podem ser prejudiciais ao meio ambiente se descartadas de maneira inadequada. Por isso, a reciclagem de pilhas é fundamental. Existem pontos de coleta específicos para o descarte correto desses materiais, onde as pilhas são direcionadas para o tratamento adequado, evitando a contaminação do solo e da água por substâncias tóxicas.
Vamos calcular o ddp de Pilhas!
Potenciais padrão de redução
Zn2+ (aq) + 2e- → Zn (s) E°= -0,76 V
Cr3+ (aq) + 3e- → Cr (s) E°= -0,74 V
Fe2+ (aq) + 2e- → Fe (s) E°= -0,44 V
Co2+ (aq) + 2e- → Co (s) E°= -0,28 V
Ni2+ (aq) + 2e- → Ni (s) E°= -0,25 V
Pb2+ (aq) + 2e- → Pb (s) E°= -0,13 V
Cu2+ (aq) + 2e- → Cu (s) E°= +0,34 V
Ag+ (aq) + e- → Ag (s) E°= +0,80 V
Exercícios:
1) Monte uma pilha de Níquel (Ni) e Cobre (Cu) e determine o ddp gerado.
2) Monte uma pilha de Crômio (Cr) e Chumbo (Pb) e determine a espécie que é o cátodo.
3) Qual par metálico dará a pilha com maior diferença de potencial (ddp).
4) Monte uma pilha de Zinco (Zn) e Ferro (Fe) e determine a direção do fluxo de elétrons, citando as espécies metálicas.
Resolução no vídeo:
Saiba mais na live sobre pilhas: https://youtube.com/live/3F3D-vnPADw
Questões no Vestibular
1. (ENEM 2021):
O quadro lista alguns dispositivos eletrônicos que estão presentes no dia a dia, bem como a faixa de força eletromotriz necessária ao seu funcionamento.
| Dispositivo eletrônico | Faixa de força eletromotriz (V) | |
| I | Relógio de parede | 1,2 a 1,5 |
| II | Celular | 3,5 a 3,8 |
| III | Câmera digital | 7,5 a 7,8 |
| IV | Carrinho de controle remoto | 10,5 a 10,9 |
| V | Notebook/Laptop | 19,5 a 20,0 |
Considere que uma bateria é construída pela associação em série de três pilhas de lítio-iodo, nas condições-padrão, conforme as semiequações de redução apresentadas.
I2 + 2 e– → 2I– Eº = + 0,54V
Li+ + 1 e– → Liº Eº = – 3,05V
Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?
a) I
b) II
c) III
d) IV
e) V
2. (FUVEST 2023):
Alguns aviões empregam fibra de carbono em uma porcentagem significativa de suas estruturas, tornando-as muito menos densas. Partes da estrutura, no entanto, são compostas por metais. Devido à baixa densidade, o alumínio seria uma boa alternativa de metal a ser usado. Entretanto, quando em contato com fibra de carbono, o alumínio é corroído. Esse processo é denominado corrosão galvânica e acontece quando dois materiais que possuem potencial elétrico diferentes são colocados em contato com um eletrólito, como uma solução salina. Para abordar esse problema, pode-se avaliar os potenciais elétricos, densidade e preço aproximado de diversos materiais apresentados na figura a seguir.

Considerando o exposto, o elemento mais adequado para ser utilizado no lugar do alumínio de forma a obter os menores custo e densidade possíveis, com a máxima resistência a corrosão possível, é:
a) Ouro.
b) Titânio.
c) Prata.
d) Cádmio.
e) Zinco.
3. (UEL 2023):
Preocupado com o nível de contaminação por metais tóxicos despejados no meio ambiente, Pedro, estudante do Ensino Médio, decidiu testar os conhecimentos em eletroquímica para reduzir íons chumbo (Pb2+) de solução ácida proveniente de águas residuárias de uma fábrica clandestina de baterias automotivas.
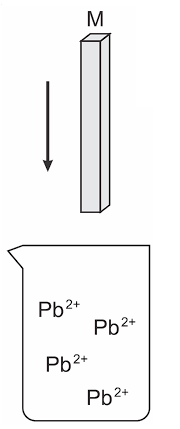
Dados:
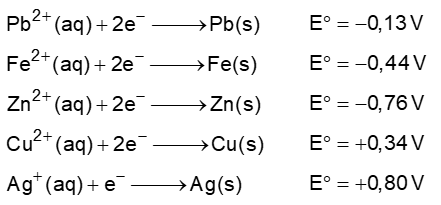
Com base na figura e nos conhecimentos sobre eletroquímica, assinale a alternativa que apresenta, corretamente, dois metais (M) que Pedro poderá utilizar para reduzir espontaneamente íons Pb2+ a chumbo metálico.
a) Ferro e Cobre.
b) Cobre e Zinco.
c) Prata e Cobre.
d) Ferro e Prata.
e) Zinco e Ferro.
4. (UEPG 2022):
Com base nos potenciais de redução das semirreações abaixo, assinale o que for correto.

01) A espécie que perde elétrons mais facilmente é o bário.
02) Se uma barra de chumbo for colocada em uma solução aquosa de Fe2+, os íons Fe2+ são reduzidos a Fe e a barra de chumbo é corroída devido a formação de íons Pb2+.
04) A espécie que ganha elétrons mais facilmente é o Pb2+.
08) O melhor agente oxidante é o bário.
5. (UCPEL 2021):
Quando uma pessoa com obturação feita de amálgama dentária morde um pedaço de papel alumínio sente um pequeno choque. Isso ocorre porque se forma uma pilha entre o Al e os elementos presentes na resina (Ag, Cu, Sn, Hg e Zn). Considere os seguintes potenciais de redução:
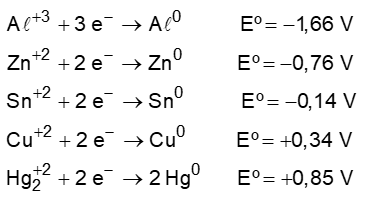
Sobre a pilha formada são feitas as seguintes afirmativas:
I. O alumínio age como o ânodo, o polo negativo, da pilha.
II. O mercúrio é o que sofrerá oxidação em relação aos demais elementos.
III. Ao se considerar apenas o Al e o Hg a ddp gerada na pilha será de 0,81V.
IV. A saliva agirá como a ponte salina conduzindo os íons de Al para a obturação.
São verdadeiras:
a) II e III.
b) I e III.
c) I e IV.
d) II e IV.
e) III e IV.
6. (PUC-CAMPINAS 2022):
A pilha lítio-iodo foi desenvolvida principalmente para ser usada em marcapassos cardíacos. Considerando as seguintes semirreações envolvidas nessa pilha, prevê-se que a voltagem fornecida por ela, nas condições-padrão, seja de
Dados: Semirreações da pilha lítio-iodo
I2 + 2 e– → 2I– Eº = + 0,54V
Li+ + 1 e– → Liº Eº = – 3,05V
a) −3,58 V
b) −2,50 V
c) +2,50 V
d) +3,58 V
e) +6,58 V
7. (ESPCEX (Aman) 2022):
“Em 1836, o químico inglês John Frederic Daniell construiu uma pilha usando metais e soluções aquosas de sais. A pilha funcionava a partir de dois eletrodos interligados. O eletrodo é, geralmente, um sistema constituído por um metal imerso em uma solução aquosa de um sal formado pelos cátions desse metal.”
Adaptado de: FONSECA, Martha Reis Marques. Química. São Paulo: Editora FTD, 2007. v. 2: Físico-Química. p. 276.
Considere a representação da notação química da pilha de Daniell (usando eletrodos de cobre e zinco), de acordo com a União Internacional de Química Pura e Aplicada (IUPAC):

Dados os potenciais padrão de redução EºZn = -0,76V e EºCu = +0,34V e considerando o funcionamento da referida pilha em condições padrão, afirma-se que
I. no eletrodo de cobre dessa pilha ocorre a corrosão da placa metálica de cobre.
II. a diferença de potencial (d.d.p.) teórica dessa pilha é de + 1,10 V.
III. nessa pilha os elétrons fluem no circuito externo, do eletrodo de zinco para o eletrodo de cobre.
IV. o símbolo de duas barras paralelas (||) representa a ponte salina (ou uma membrana porosa), cuja finalidade é manter as duas semicelas eletricamente neutras, por meio da migração de íons (corrente iônica).
V. a equação da reação global dessa pilha é Zn2+ (aq) + Cu(s) → Zn (s) + Cu2+ (aq)
Das afirmativas feitas, estão corretas apenas
a) I, II e IV.
b) I, III e V.
c) II, IV e V.
d) II, III e IV.
e) III, IV e V.
8. (UFJF-pism 3 2021):
Existem vários tipos de pilhas e baterias disponíveis comercialmente. Entre eles, a bateria de níquel-cádmio, que foi amplamente utilizada em equipamentos eletrônicos por ser uma bateria recarregável e de fácil miniaturização. No entanto, esse tipo de bateria foi substituído por baterias como a “hidreto metálico” e de “íons lítio”, que possuem menos riscos ambientais. Assim como em outras baterias, a níquel-cádmio utiliza uma pasta básica, na qual o KOH é usado como meio eletrolítico entre o ânodo e cátodo. A reação química dentro dessa bateria é:
Cd (s) + 2 Ni(OH)2 (s) → Cd(OH)2 (s) + 2 Ni(OH)2 (s)
DADOS:
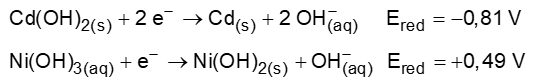
Sobre a bateria descrita acima, responda:
a) Escreva a semirreação que ocorre no cátodo.
b) Qual espécie está sofrendo oxidação?
c) Calcule o valor do potencial dessa bateria.
9. (Acafe 2022):
Sob condições padrão, para uma determinada célula eletrolítica, considere as seguintes semirreações de redução e seus respectivos potenciais:

Uma vez ligadas em série, assinale a alternativa que contém o número mínimo de células eletrolíticas necessárias para se obter uma diferença de potencial de 4,0V.
a) 5
b) 2
c) 3
d) 4
10. (Uema 2021):
Pilhas e baterias são amplamente utilizadas em nosso cotidiano como fonte de energia, em diversos aparelhos eletrônicos, facilitando nossa vida.
A energia gerada pela fonte, acima tratada, é oriunda de uma reação de
a) precipitação.
b) neutralização.
c) adição.
d) decomposição.
e) oxirredução.
Gabarito:
Questão 1: [D]
Questão 2: [B]
Questão 3: [E]
Questão 4: [01+04 =05]
Questão 5: [C]
Questão 6: [D]
Questão 7: [D]
Questão 9: [A]
Questão 10: [E]
TESTE – Questões formativas (1/2)
Questão 1 – Pilhas
Pilhas e baterias são amplamente utilizadas em nosso cotidiano como fonte de energia, em diversos aparelhos eletrônicos, facilitando nossa vida.
A energia gerada pela fonte, acima tratada, é oriunda de uma reação de
a) precipitação.
b) neutralização.
c) adição.
d) decomposição.
e) oxirredução.
Questão 2 – Pilhas
A galvanostegia é um processo químico que consiste na aplicação, mediante deposição eletrolítica, de revestimentos metálicos aderentes, para modificar as propriedades ou as dimensões da superfície de um metal. Ela pode melhorar o aspecto, a dureza ou a resistência à corrosão e à formação de manchas superficiais.
Nos processos de galvanostegia, o objeto a ser tratado é imerso em uma solução que contenha o metal a ser depositado, sob a forma de íons, sejam simples ou complexos.
Disponível em: <https://editorarealize.com.br/revistas/conapesc/trabalhos/TRABALHO_EV058_MD1_SA86_ID1941_17052016200759.pdf>. Acesso em: 22 jul. 2019. Adaptado.
Sabe-se que o objeto a ser niquelado é ligado eletricamente ao polo negativo de um gerador com corrente contínua.
Sendo assim, admite-se que a reação que ocorre no cátodo seja representada por

Questão 3 – Pilhas
No capítulo Linhas de Força, Sacks relembra suas experiências com eletroquímica, em especial sua predileção pela pilha de Daniell, conforme o trecho “Mas minha favorita continuou sendo a pilha de Daniell, e quando nos modernizamos e instalamos uma nova pilha seca para a campainha, eu me apropriei da de Daniell.” (SACKS, O. Tio Tungstênio: Memórias de uma infância química. São Paulo: Cia. das Letras, 2002). A pilha de Daniell, citada no texto, está representada abaixo:

O potencial padrão da pilha de Daniell, a partir das informações anteriores, é
a) +1,10 V
b) –1,10 V
c) +0,42 V
d) –0,42 V
e) +0,26 V
Questão 4 – Pilhas
Uma pilha é formada com eletrodos de alumínio e ouro que apresentam os potenciais de redução, respectivamente, – 1,66 volts e 1,50 volts.
Após analisar as características dessa pilha, pode-se afirmar corretamente que
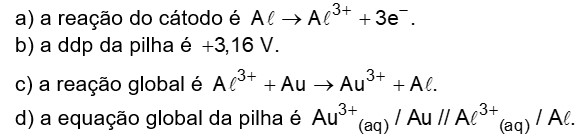
Questão 5 – Pilhas
Pilhas são dispositivos que transformam energia química em energia elétrica por meio de um sistema montado para aproveitar o fluxo de elétrons provenientes de uma reação química de oxirredução, conforme mostra o seguinte exemplo.
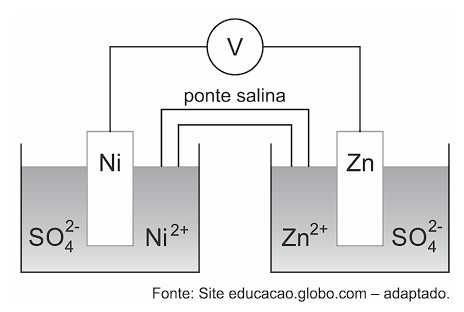
Considerando que os Potenciais de redução do Níquel e do Zinco são, respectivamente, -0,25V e -0,76V é correto afirmar que
a) o níquel é oxidado e o zinco é reduzido.
b) o zinco é o ânodo e o níquel é o cátodo.
c) o níquel é o agente redutor e o zinco é o agente oxidante.
d) o níquel e o zinco geram uma força eletromotriz de -1,01V nesta pilha.
Respostas:
Digite suas respostas no link:



