1. (Eear 2022)
A descoberta do elétron e sua interação com campos elétricos e magnéticos, através dos experimentos com a ampola de Croockes, possibilitou a idealização do modelo atômico de
a) Dalton.
b) Thomson.
c) Rutherford.
d) Bohr.
2. (Unifor – Medicina 2023)
A tabela abaixo apresenta o número atômico e o número de elétrons das seguintes espécies.
| Espécie | Número atômico | Número de elétrons | Número de massa |
| A | 11 | 10 | 23 |
| B | 20 | 18 | 40 |
| C | 20 | 20 | 42 |
| D | 20 | 22 | 42 |
| E | 11 | 11 | 23 |
Com base nos dados projetados, considere as seguintes afirmativas:
I. A é ânion de E.
II. B é cátion de C.
III. C e D são isóbaros.
IV. D e E são isótonos.
V. A e E são isoeletrônicos.
É correto o que se afirma apenas em
a) I e II.
b) II e III.
c) I e IV.
d) III e V.
e) IV e V
3. (Pucrs Medicina 2023)
Uma célula nervosa transmite um sinal elétrico por meio de um mecanismo de transporte de íons sódio para fora da membrana celular e de íons potássio para dentro da membrana celular. As configurações eletrônicas para os íons Na+ e K+ são, respectivamente, __________________.
Dados: Na (Z = 11); K (Z = 19).
a) 1s2 2s2 2p6 e 1s2 2s2 2p6 3s2 3p6
b) 1s2 2s2 2p6 3s2 e 1s2 2s2 2p6 3s2 3p6
c) 1s2 2s2 2p6 3s1 e 1s2 2s2 2p6 3s2 3p6 4s1
d) 1s2 2s2 2p6 3s2 e 1s2 2s2 2p6 3s2 3p6 4s2
4. (Ita 2023)
Considere as seguintes afirmações relacionadas a átomos e íons atômicos no estado gasoso:
I. A afinidade eletrônica do átomo de oxigênio é maior do que a do ânion O−.
II. A energia de ionização do átomo de oxigênio é maior do que a do ânion O2−.
III. O raio atômico do átomo de oxigênio é maior do que o do ânion O−.
IV. O átomo de oxigênio tem maior afinidade eletrônica e menor energia de ionização do que o átomo de nitrogênio.
Das afirmações I a IV, acima destacadas, são CORRETAS
a) apenas I e II.
b) apenas I, II e IV.
c) apenas I e III.
d) penas II, III e IV.
e) apenas III e IV.
5. (Espcex (Aman) 2023)
A elaboração de representações científicas é muito importante para organizar observações e conclusões resultantes do trabalho de pesquisa dos cientistas. Na Química, um dos mais emblemáticos exemplos dessa prática são os modelos atômicos. Cada um reúne a contribuição de diversos estudiosos, apesar de geralmente ser atribuído a apenas um deles. Nas alternativas abaixo, são apresentados alguns dos modelos atômicos (por meio da referência nominal aos seus respectivos elaboradores) e os nomes de alguns cientistas cujos trabalhos, citados entre parênteses, contribuíram para a elaboração de alguns desses modelos. Podemos afirmar que a relação entre o modelo atômico e o estudioso cujo trabalho contribuiu para a construção do respectivo modelo está corretamente apresentada na alternativa:
a) Modelo de Dalton – Plücker (comprovação da existência dos raios catódicos)
b) Modelo de Thomson – Becquerel (observação do fenômeno da radioatividade)
c) Modelo de Rutherford – Heisenberg (Princípio da Incerteza)
d) Modelo de Böhr – Planck (propôs o conceito de quantização da energia)
e) Modelo de Sommerfeld – Chadwick (descoberta da partícula nêutron)
6. (G1 – col. naval 2021)
Dadas as distribuições eletrônicas:
I. 1s2 2s2 2p6 3s1
II. 1s2 2s2 2p6 3s2 3p6 4s2
III. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
IV. 1s2 2s2 2p4
V. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
É INCORRETO afirmar que:
a) a distribuição I refere-se a um metal alcalino do 1º período.
b) a distribuição II refere-se a um metal alcalino terroso do 4º período.
c) a distribuição III refere-se a um gás nobre do 4º período.
d) a distribuição IV refere-se a um calcogênio do 2º período.
e) a distribuição V refere-se a um metal alcalino terroso do 5º período.
7. (Espcex (Aman) 2020)
Considerando a distribuição eletrônica do átomo de bismuto Bi (Z=83) no seu estado fundamental, conforme o diagrama de Linus Pauling, pode-se afirmar que seu subnível mais energético e o período em que se encontra na tabela periódica são, respectivamente:
a) 5d5 e 5º período.
b) 5d9 e 6º período.
c) 6s2 e 6º período.
d) 6p5 e 5º período.
e) 6p3 e 6º período.
8. (Uece 2020)
Considere o átomo de magnésio (z=12) que apresenta as seguintes distribuições eletrônicas:
1s2 2s2 2p6 3s2 e 1s2 2s2 2p6 3s1 3p1
Atente para o que se afirma a seguir sobre essas distribuições:
I. Ocorre liberação de energia na passagem da primeira distribuição para a segunda.
II. Ocorre perda de um elétron na passagem da segunda distribuição para a primeira.
III. Na passagem da primeira distribuição para a segunda, ocorre absorção de energia.
IV. A primeira distribuição eletrônica representa a configuração do estado excitado.
É correto o que se afirma somente em
a) I e II.
b) III.
c) II e IV.
d) I, III e IV.
9. (Espcex (Aman) 2018)
Quando um átomo, ou um grupo de átomos, perde a neutralidade elétrica, passa a ser denominado de íon. Sendo assim, o íon é formado quando o átomo (ou grupo de átomos) ganha ou perde elétrons. Logicamente, esse fato interfere na distribuição eletrônica da espécie química. Todavia, várias espécies químicas podem possuir a mesma distribuição eletrônica.
Considere as espécies químicas listadas na tabela a seguir:
| I | II | III | IV | V | VI |
| 20Ca2+ | 16S2- | 9F1- | 17Cl1- | 38Sr2+ | 24Cr3+ |
A distribuição eletrônica 1s2 2s2 2p6 3s2 3p6 (segundo o Diagrama de Linus Pauling) pode corresponder, apenas, à distribuição eletrônica das espécies
a) I, II, III e VI.
b) II, III, IV e V.
c) III, IV e V.
d) I, II e IV.
e) I, V e VI.
10. (Uema 2021)
A Tabela Periódica atualizada apresenta 118 elementos químicos (92 naturais e 26 artificiais), devidamente identificados. Os elementos estão organizados em ordem crescente de número atômico e, assim, consegue-se agrupá-los de modo a reunirem propriedades químicas e características semelhantes.
https://www.todamateria.com.br/tabela-periodica. Acessado em 12/10/2020.
Considerando os metais alcalinos terrosos (grupo 2 da Tabela Periódica), é possível afirmar que seus elétrons da camada de valência estão
Dados: Be (Z=4) , Mg (Z=12), Ca (Z=20), Sr (Z=38), Ba (Z=56) e Ra (Z=88)
a) no mesmo nível para todos os elementos.
b) no subnível do seu respectivo nível.
c) desemparelhados com menor energia.
d) impossibilitados de formar ligação química.
e) no subnível do seu respectivo nível.
11. (G1 – ifsp 2017)
Desde a descoberta de um tipo de radiação por Röentgen em 1895, a aplicação da radiação é extremamente importante na sociedade moderna, principalmente como fonte de geração de energia elétrica, pelas usinas nucleares, e como método de diagnóstico e tratamento na medicina. Entretanto, as desvantagens da sua utilização são os acidentes nucleares, os riscos de contaminação e o lixo radioativo. De fato, no ano de 1986, em Chernobyl, ocorreu a explosão de uma usina, liberando cerca de 400 vezes mais contaminação que a bomba atômica de Hiroshima e matando mais de mil pessoas. Chernobyl trabalhava com o átomo de Césio. Um ano depois, em Goiânia, houve um acidente com contaminação com Césio – 137 o maior acidente nuclear do Brasil e o primeiro no mundo fora de uma usina nuclear.
É correto afirmar que o elemento radioativo Césio, na tabela periódica, é classificado como
a) metal alcalino.
b) calcogênio.
c) semimetal.
d) actinoide.
e) não metal.
12. (Unisc 2017)
Pertencem à família dos calcogênios os elementos químicos
a) flúor e bromo.
b) oxigênio e nitrogênio.
c) selênio e telúrio.
d) sódio e lítio.
e) estrôncio e bário.
13. (IFSUL – 2017)
Segundo o Centro de Tecnologia Mineral, cerca de 70% dos metais pesados e demais elementos potencialmente tóxicos encontrados em lixões e aterros sanitários são provenientes de equipamentos eletrônicos, entre eles, computadores, celulares e baterias descartados, que contaminam o solo e os lençóis freáticos, colocando em risco a saúde pública, pois causam muitas doenças graves e a grande maioria também é cancerígeno.
A tabela a seguir apresenta alguns destes elementos.
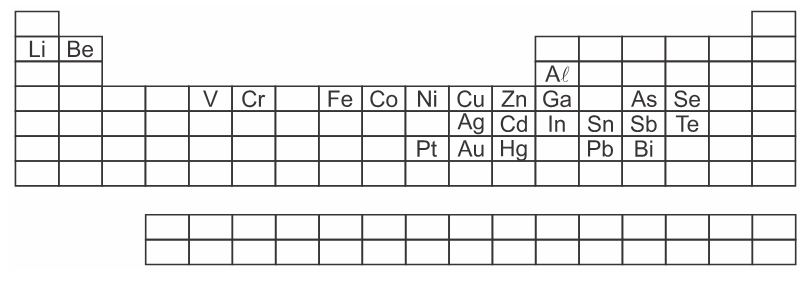
Os elementos químicos que pertencem à família dos Calcogênios são:
a) Zn e Cd.
b) Se e Te.
c) Al, Ga e In.
d) As, Sb e Bi.
14. (Unisc 2016)
Um elemento químico da família dos gases nobres está situado no terceiro período da tabela periódica. Qual é esse elemento?
a) Hélio.
b) Argônio.
c) Cloro.
d) Neônio.
e) Iodo.
15. (G1 – ifce 2016)
A tabela periódica é uma ferramenta muito útil para os químicos, embora ela tenha sido pensada a mais de um século atrás. Sobre a organização sistemática dos elementos, é verdadeiro afirmar-se que
a) os elementos de um mesmo grupo apresentam propriedades químicas semelhantes, no entanto o número de elétrons na camada de valência de átomos de um mesmo grupo sempre sofre variação.
b) os metais são elementos apresentados em todas as colunas da tabela periódica.
c) todos os gases nobres estão descritos em um único período na tabela periódica.
d) a tabela periódica atual ordena os elementos em ordem crescente de número atômico.
e) o raio atômico é a propriedade periódica que indica que, quanto mais elétrons presentes no átomo, maior ele será.
16. (Udesc 2016)
O planeta B possui sua própria tabela periódica, sendo que uma parte dela está representada abaixo. As propriedades periódicas no planeta B seguem as mesmas tendências observadas na Terra.

Com base nas informações acima, analise as proposições.
I. O elemento Z possui raio atômico maior que Q.
II. A ordem de eletronegatividade no segundo período é Z < A < D.
III. O elemento L possui uma eletronegatividade maior que T.
IV. O maior raio atômico, nessa parte da tabela periódica, é o de Q.
V. O elemento X é menos eletronegativo que T.
Assinale a alternativa correta.
a) Somente as afirmativas II, IV e V são verdadeiras.
b) Somente as afirmativas I, II e V são verdadeiras.
c) Somente as afirmativas I, II, III e V são verdadeiras.
d) Somente as afirmativas IV e V são verdadeiras.
e) Somente a afirmativa IV é verdadeira.
17. (G1 – ifsul 2016)
Sobre o elemento químico Ferro que tem número atômico igual a 26 É correto afirmar que
a) tem símbolo F.
b) é líquido à temperatura ambiente.
c) pertence ao grupo dos metais alcalinos.
d) está localizado no quarto período da tabela periódica.
18. (G1 – cftmg 2018)
A figura seguinte representa um fenômeno ocorrido ao atritar um pente em uma flanela e depois aproximá-lo de papel picado pelo fato de o pente ficar eletrizado por atrito.
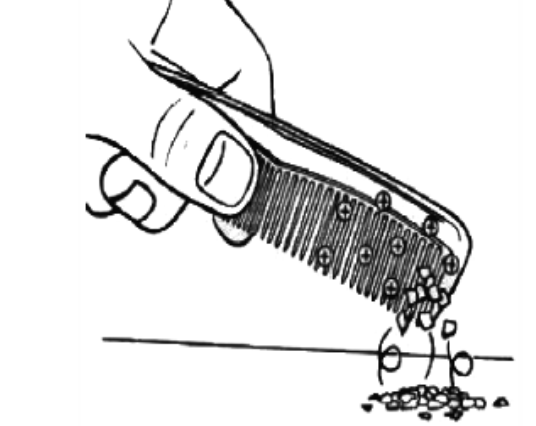
Tendo em vista a evolução dos modelos atômicos, de Dalton até Bohr, o primeiro modelo que explica o fenômeno da eletrização é o de
a) Bohr.
b) Dalton.
c) Thomson.
d) Rutherford.
19. (Udesc 2016)
Na Inglaterra por volta de 1900, uma série de experimentos realizados por cientistas, como Sir Joseph John Thompson (1856-1940) e Ernest Rutherford (1871-1937), estabeleceu um modelo do átomo que serviu de base à teoria atômica. Atualmente, sabe-se que três partículas subatômicas são os constituintes de todos os átomos: próton, nêutrons e elétrons. Desta forma, o átomo constituído por 17 prótons, 18 nêutrons e 17 elétrons possui número atômico e número de massa, sequencialmente, igual a:
a) 17 e 18
b) 34 e 52
c) 17 e 17
d) 17 e 35
e) 35 e 17
20. (IFSUL – 2016)
No interior do tubo da lâmpada fluorescente existem átomos de argônio e átomos de mercúrio. Quando a lâmpada está em funcionamento, os átomos de Ar ionizados chocam-se com os átomos de Hg. A cada choque, o átomo de Hg recebe determinada quantidade de energia que faz com que seus elétrons passem de um nível de energia para outro, afastando-se do núcleo. Ao retornar ao seu nível de origem, os elétrons do átomo de Hg emitem grande quantidade de energia na forma de radiação ultravioleta. Esses raios não são visíveis, porém eles excitam os elétrons do átomo de P presente na lateral do tubo, que absorvem energia e emitem luz visível para o ambiente.
O modelo atômico capaz de explicar o funcionamento da lâmpada fluorescente é
a) Modelo de Dalton.
b) Modelo de Thomson.
c) Modelo de Rutherford.
d) Modelo de Böhr.
Gabarito
1 – B
2 – B
3 – A
4 – B
5 – D
6 – A
7 – E
8 – B
9 – D
10 – B
11 – A
12 – C
13 – B
14 – B
15 – D
16 – A
17 – D
18 – C
19 – D
20 – D



