A termoquímica é o estudo da transferência de calor que ocorre durante uma reação química. Existem dois tipos de processos termoquímicos: endotérmicos e exotérmicos. Processos endotérmicos: São processos que absorvem energia térmica do meio ambiente, gerando uma sensação de frio. Na termoquímica, um processo endotérmico é representado pela absorção de calor. Isso significa que, durante a reação, ocorre uma transferência de energia da vizinhança para o sistema. O exemplo mais comum de processo endotérmico é a dissolução de cloreto de amônio em água. Quando o cloreto de amônio é dissolvido em água, ele absorve energia térmica da água e do ambiente, gerando uma sensação de frio. Processos exotérmicos: São processos que liberam energia térmica para o meio ambiente, gerando uma sensação de calor. Na termoquímica, um processo exotérmico é representado pela liberação de calor. Isso significa que, durante a reação, ocorre uma transferência de energia do sistema para a vizinhança. O exemplo mais comum de processo exotérmico é a combustão de uma vela. Durante a combustão, a cera da vela é oxidada e libera energia térmica para o ambiente, gerando uma sensação de calor.
- Conceitos Básicos: A termoquímica é a área da química que estuda as relações entre calor e as reações químicas. Os conceitos básicos incluem a definição de calor, energia interna, entalpia, capacidade calorífica e calor específico. Calor: É a energia térmica transferida de um corpo para outro em virtude da diferença de temperatura entre eles. Na termoquímica, o calor é uma das formas de energia envolvidas nas reações químicas. Energia interna: É a energia total de um sistema, incluindo sua energia cinética e potencial. Na termoquímica, a energia interna é importante porque ela determina a quantidade de calor que pode ser trocada com o ambiente durante uma reação química. Entalpia: É a quantidade de calor trocada entre um sistema e o ambiente a pressão constante. A entalpia é representada pela letra H e é uma grandeza termodinâmica que está relacionada com a energia interna do sistema. Capacidade calorífica: É a quantidade de calor necessária para elevar a temperatura de uma determinada quantidade de substância em uma unidade de temperatura. A capacidade calorífica é uma propriedade física das substâncias e é importante para entender como as substâncias armazenam e liberam calor. Calor específico: É a quantidade de calor necessária para elevar a temperatura de uma unidade de massa de uma determinada substância em uma unidade de temperatura. O calor específico é uma propriedade física das substâncias e é importante para entender como as substâncias armazenam e liberam calor de maneira diferente.
- Reações Endotérmicas e Exotérmicas: Uma reação exotérmica libera calor para o ambiente, enquanto uma reação endotérmica absorve calor do ambiente. Esses conceitos são importantes porque ajudam a entender a direção das reações químicas.
- Lei de Hess: A lei de Hess é uma lei fundamental da termoquímica que estabelece que a variação de entalpia de uma reação química é independente do caminho pelo qual a reação ocorre. Isso significa que a variação de entalpia pode ser calculada a partir dos entalpias dos reagentes e produtos, independentemente das etapas intermediárias.
- Entalpia Padrão de Formação: A entalpia padrão de formação é a quantidade de calor liberada ou absorvida quando uma molécula é formada a partir dos elementos que a compõem. É um valor importante porque pode ser usado para calcular a variação de entalpia em qualquer reação química.
- Lei de Kirchhoff: A lei de Kirchhoff é uma extensão da lei de Hess que leva em consideração as variações de temperatura que ocorrem durante uma reação química. Ela é útil para prever o efeito da temperatura na variação de entalpia de uma reação.
- Ciclo de Born-Haber: O ciclo de Born-Haber é um modelo teórico que descreve as etapas envolvidas na formação de um composto iônico a partir de seus elementos constituintes. Ele é importante porque permite calcular a entalpia de formação de compostos iônicos complexos a partir de dados experimentais.
Termoquímica nos vestibulares e ENEM nos últimos três anos (2023-2021)
- ENEM 4%
- FUVEST 10%
- ITA 15%
- UNESP 19%
- UNICAMP 12%
- UNIFESP 15%
1. (Unicamp 2023)
A caiação ou pintura com cal hidratada (Ca(OH)2) é uma das formas mais antigas para o revestimento da fachada de edifícios. A cal virgem (CaO) – produzida a partir do aquecimento do calcário (CaCO3) –, ao ser colocada em água, forma a cal hidratada que, uma vez aplicada à parede e em contato com o CO2 do ar atmosférico, vai se transformando em seu precursor, o carbonato de cálcio. Dessa forma, o carbonato de cálcio fica aderido à parede, protegendo-a, conservando-a e embelezando-a.
Considere as equações a seguir:
I) CaCO3 → CaO + CO2 ΔH = 178 kJ/ mol
II) CaO + H2O → Ca(OH)2 ΔH = – 109 KJ/mol
III) Ca(OH)2 + CO2 → CaCO3 + H2O ΔH = ?
Levando em conta apenas as equações do processo de transformação e produção do carbonato de cálcio (equações I a III), pode-se afirmar que o processo
a) pode ser considerado carbono neutro e que a última equação representa uma reação que levaria ao aquecimento da parede onde a cal foi aplicada.
b) pode ser considerado carbono neutro e que a última equação representa uma reação que levaria ao resfriamento da parede onde a cal foi aplicada.
c) não pode ser considerado carbono neutro e que a última equação representa uma reação que levaria ao aquecimento da parede onde a cal foi aplicada.
d) não pode ser considerado carbono neutro e que a última equação representa uma reação que levaria ao resfriamento da parede onde a cal foi aplicada.
2. (Uerj 2023)
A reação química entre metano e cloro molecular produz ácido clorídrico e diclorometano, sendo este segundo composto empregado como solvente em processos industriais. Os valores de energia de ligação envolvidos na reação estão apresentados na tabela a seguir.
| LIGAÇÃO | ENERGIA DE LIGAÇÃO (kJ/mol) |
| C – H | 410 |
| Cl – Cl | 240 |
| C – Cl | 330 |
| H-Cl | 430 |
A energia, em quilojoules, liberada na formação de 1,0 mol de diclorometano é igual a:
a) 220
b) 400
c) 640
d) 850
3. (Unesp 2023)
Considere as seguintes informações sobre o óleo diesel, uma mistura de hidrocarbonetos de fórmula geral CnH2n+2 :
Fórmula molecular média: C12H26
Massa molar média: 170 g/mol
Poder calorífico aproximado: 45000 kJ/kg
Um gerador de potência igual a 180 kW trabalhou sob regime de potência máxima durante 1 hora. Caso fosse possível transformar em energia elétrica toda a energia que se obtém pela queima do óleo diesel, a quantidade de óleo diesel consumida pelo gerador em uma hora seria próxima de
a) 254 mol.
b) 169 mol.
c) 42 mol.
d) 85 mol.
e) 210 mol.
4. (Integrado – Medicina 2023)
“A entalpia de formação, também denominada entalpia-padrão de formação, ou calor-padrão de formação, é o cálculo do calor liberado ou absorvido na formação de 1 mol de uma substância a partir de substâncias simples, no estado padrão. É impossível calcular o valor absoluto das entalpias de cada substância, mas é possível calcular a variação da entalpia que ocorre na reação, por meio de um calorímetro.”
Disponível em: https://brasilescola.uol.com.br/quimica/entalpia-formacao. Acesso em 05 de out. 2022
Com relação ao exposto, observe as variações de entalpia das reações a seguir.
C(s) + O2(g) → CO2 (g) ΔHº = -393,5 KJ/mol
H2 + ½ O2 (g) → H2O (g) ΔHº = -286,0 KJ/mol
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (g) ΔHº = -2807,5 KJ/mol
A partir da reação de formação da glicose 6C(s) + 3 O2 (g) +6H2(g) → C6H12O6 (s), qual o valor de sua entalpia de formação?
a) – 409,8 kJ/mol
b) – 1.269,5 kJ/mol
c) + 1.528,2 kJ/mol
d) + 1.605,2 kJ/mol
e) – 3.486,8 kJ/mol
5. (Unesp 2023)
Analise os diagramas de entalpias de reações parciais, associadas com a reação de cal viva sólida, CaO(s), com água líquida, para a produção de cal hidratada sólida, Ca(OH)2(s).
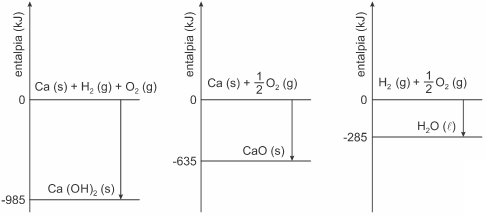
A variação de entalpia dessa reação de cal viva com água líquida, para produzir cal hidratada, é igual a
a) – 1 905 kJ/mol.
b) – 65 kJ/mol.
c) + 95 kJ/mol.
d) – 1 620 kJ/mol.
e) + 2 890 kJ/mol.
6. (Pucpr 2023)
Germain Henri Hess (1802-1850) Hess nasceu em Genebra, na Suíça. Médico e químico estudioso da termodinâmica, ele foi um dos pioneiros da Físico-Química. Em 1840, ao estudar os calores das reações químicas, enunciou uma lei que ficou conhecida como Lei de Hess: “A variação de entalpia de uma reação química depende apenas dos estados inicial e final da reação, não importando o caminho da reação”.
Analise as equações químicas apresentadas a seguir.
Combustão do etano: C2H6 (g) + 7/2 O2 (g) → 2 CO2(g) + 3 H2O (l) ΔHº = -1558,3 KJ/mol
Formação da água: H2 (g) + 1/2 O2 (g) → H2O (l) ΔHº = -285,8 KJ/mol
Formação do dióxido de carbono: C(grafite) + O2 (g) → CO2(g) ΔHº = -393,5 KJ/mol
Utilizando a lei de Hess, determine a variação de entalpia (ΔH) da reação de formação do etano gasoso a partir de hidrogênio gasoso e carbono grafite.
a) -43,05 kJ/mol
b) -86,1 kJ/mol
c) +86,1 kJ/mol
d) +307,1 kJ/mol
e) -409,2 kJ/mol
7. (Unesp 2022)
A variação de entalpia, associada à formação de um cristal iônico sólido a partir de seus íons no estado gasoso, é conhecida como energia reticular. Essa energia é difícil de ser medida diretamente, mas pode ser calculada de forma indireta, utilizando-se a Lei de Hess, a partir de outras transformações, cuja variação de entalpia é conhecida. Esse caminho para a determinação da energia reticular é conhecido como ciclo de Born-Haber. O diagrama a seguir mostra as etapas desse ciclo para o cloreto de sódio (NaCl).
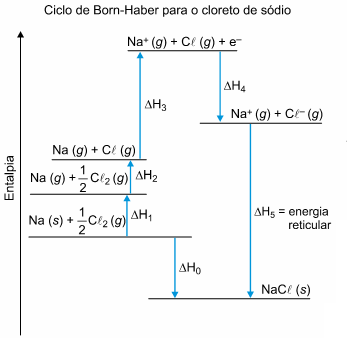
Nesse diagrama, a sublimação do sódio metálico, a primeira energia de ionização do elemento sódio e a afinidade eletrônica do elemento cloro correspondem, respectivamente, aos valores de
a) ∆H2, ∆H3 e ∆H4
b) ∆H1, ∆H0 e ∆H5
c) ∆H1, ∆H4 e ∆H3
d) ∆H2, ∆H4 e ∆H3
e) ∆H1, ∆H3 e ∆H4
8. (Acafe 2022)
Sob condições apropriadas a síntese do benzeno pode ser obtida a partir do acetileno.
3 C2H2 (g) → C6H6 (l)
C6H6 (l) + 15/2 O2 (g) → 6 CO2 (g) + 3 H2O (l) ∆H = – 3266 KJ /mol
C2H2 (g) + 5/2 O2 (g) → 2 CO2 (g) + H2O (l) ∆H = – 1298 KJ /mol
Baseado nos conceitos químicos e nas informações fornecidas assinale a alternativa que contém o valor da energia absorvida ou liberada na síntese de 195g de benzeno a partir do acetileno.
Dados: C = 12 g/mol e H = 1 g/mol
a) – 1968 kJ
b) – 628 kJ
c) + 628 kJ
d) – 1570 kJ
9. (Ucs 2022)
Quando aquecidos a uma temperatura elevada, o coque e o vapor de água produzem uma mistura conhecida como “gás de água” que pode ser utilizada como combustível para outras reações. A equação química que descreve simplificadamente a reação de obtenção desse gás encontra-se representada abaixo:
C (s) + H2O (g) → CO(g) + H2 (g)
Supondo que 3,6 kg de coque sejam completamente convertidos em “gás de água”, e assumindo que o coque tenha a mesma entalpia padrão de formação que o carbono grafite, pode-se concluir que a variação de entalpia do processo (em kJ) é igual a
Dados: ∆H H2O (g) = – 241,8 KJ /mol; ∆H CO (g) = – 110,5 KJ /mol; C = 12g/mol.
a) 9759.
b) 19518.
c) 29277.
d) 39390.
e) 58818.
Gabarito
1 [A]
2 [A]
3 [D]
4 [B]
5 [B]
6 [B]
7 [E]
8 [D]
9 [D]
Vídeos que podem ajudar a compreender melhor o conteúdo de Termoquímica.




professor, ainda não entendi ainda o conceito de reações exotérmicas e endotérmicas
Olá Lucca, espero que tenha entendido em nossa aula. Obrigado!