Química Zen: O Equilíbrio Químico Descomplicado
A química pode ser um bicho de sete cabeças para muita gente. Fórmulas, reações, balanços… tudo isso pode parecer muito complicado e difícil de entender. Mas, que tal tentar deixar essa matéria mais zen? Sim, é possível! Aprender sobre equilíbrio químico pode ser uma tarefa tranquila e descomplicada, basta ter as informações certas. Neste artigo, vamos te ensinar como descomplicar o equilíbrio químico e torná-lo uma parte mais tranquila do seu estudo.
Que tal deixar a química mais zen?
Primeiro, vamos falar sobre a importância de deixar a química mais zen. Quando nos estressamos ou ficamos ansiosos, nosso cérebro tem mais dificuldade em aprender e reter informações. Por isso, se queremos ter um bom desempenho em química, é fundamental que consigamos estudar de maneira tranquila e serena. Além disso, quando entendemos um assunto de forma clara, temos mais facilidade em aplicá-lo em nossa vida e em situações práticas.
Aprenda a descomplicar o equilíbrio químico!
Agora, vamos para a prática: como descomplicar o equilíbrio químico? Primeiro, é importante entender que esse assunto se trata de uma relação entre as concentrações dos reagentes e dos produtos em uma reação química. Para facilitar a compreensão, podemos utilizar a Lei de Ação das Massas, que nos ajuda a determinar em que direção a reação ocorre. Outra dica importante é estudar por meio de exercícios e exemplos práticos, que ajudam a fixar melhor os conceitos.
Veja essa conversa entre Omar e Mitta:
Omar: Olá! Eu estou estudando equilíbrio químico em soluções, mas ainda não entendi muito bem como ele ocorre. Você poderia me explicar?
Mitta: Claro, Clara! O equilíbrio químico em uma solução ocorre quando a taxa de reação direta é igual à taxa de reação inversa. Isso significa que a concentração dos reagentes e produtos se estabiliza, e as quantidades permanecem constantes.
Omar: Entendi. E como a concentração dos reagentes e produtos se estabiliza?
Mitta: Bem, vamos usar um exemplo para ilustrar. Vamos considerar a dissolução de um sal em água. Quando um sal se dissolve, ele se dissocia em íons, que são os reagentes da reação. Em um primeiro momento, a dissociação é rápida e a concentração dos íons aumenta. Conforme a concentração dos íons aumenta, a taxa de reação direta diminui e a taxa de reação inversa aumenta.
Omar: E por que a taxa de reação inversa aumenta?
Mitta: Isso ocorre porque os íons reagem entre si para formar o sal original novamente. À medida que os íons reagem, a concentração deles diminui. Quando a concentração dos íons diminui, a taxa de reação direta aumenta novamente, e a taxa de reação inversa diminui.
Omar: Então, em um determinado momento, as taxas de reação direta e inversa se igualam, e a concentração dos reagentes e produtos se estabiliza?
Mitta: Isso mesmo, Omar! Quando as taxas de reação direta e inversa se igualam, o sistema atinge o equilíbrio químico. A partir desse ponto, a concentração dos reagentes e produtos permanece constante, mas a reação continua a ocorrer, com as moléculas e íons se convertendo entre si, porém sem alteração na concentração total dos reagentes e produtos.
Omar: Olá Mitta! Estou com dúvidas sobre como calcular a constante de equilíbrio em uma reação química. Poderia me ajudar?
Mitta: Claro, Omar! A constante de equilíbrio, ou Kc, é uma medida da posição do equilíbrio químico em uma reação. Ela é obtida pela razão entre a concentração dos produtos e a concentração dos reagentes, cada um elevado a sua respectiva estequiometria na reação.
Omar: Entendi. Mas e se a reação não estiver em equilíbrio, como podemos calcular a constante de equilíbrio?
Mitta: Nesse caso, podemos medir a concentração dos reagentes e produtos e, em seguida, introduzir esses valores na expressão da constante de equilíbrio. Dessa forma, podemos determinar o valor de Kc e, a partir disso, saber a posição do equilíbrio químico da reação.
Omar: E como podemos interpretar o valor da constante de equilíbrio?
Mitta: O valor de Kc indica se a reação tende a se deslocar para a direita (formação de produtos) ou para a esquerda (formação de reagentes) para atingir o equilíbrio químico. Se Kc for maior do que 1, a reação tende a formar mais produtos, ou seja, o equilíbrio químico está deslocado para a direita. Já se Kc for menor do que 1, a reação tende a formar mais reagentes, e o equilíbrio químico está deslocado para a esquerda. Se Kc for igual a 1, isso indica que as concentrações dos reagentes e produtos estão iguais e que a reação está em equilíbrio.
Omar: Muito obrigado pela explicação, Mitta! Agora entendi melhor como calcular e interpretar a constante de equilíbrio em uma reação química.
Vamos ver a aplicação do equilíbrio químico na concentração de H+ e no pH, explore o simulador disponível no website phet.colorado.edu. :
Material da University of Colorado Bouder Phet interactive Simulator: https://phet.colorado.edu/pt_BR/simulations/ph-scale
Conclusão
Descomplicar a química é possível e torna o estudo dessa matéria mais tranquilo e sereno. No caso do equilíbrio químico, é fundamental ter as informações certas e entender que se trata de uma relação entre as concentrações dos reagentes e produtos em uma reação química. Utilizar a Lei de Ação das Massas e estudar por meio de exercícios práticos são dicas muito úteis para aprender sobre esse assunto sem complicações. Com a prática e a paciência, qualquer um pode se tornar um mestre na química zen!
1. (Ita 2023)
Em uma determinada temperatura, uma mistura gasosa contendo as substâncias X2, Y2 e XY é adicionada a um recipiente de 1 L, nas concentrações, em mol/L de 0,4, 0,4 e 0,8, respectivamente. A equação química que representa a reação, cuja constante de equilíbrio é igual a 16, é dada por X2 + Y2 ⇌ 2XY
Assinale a opção que contém a concentração aproximada, em mol/L, do produto XY, após a reação atingir o equilíbrio.
a) 0,5.
b) 0,8.
c) 1,1.
d) 2,2.
e) 2,7.
2. (Uerj 2023)
Considere a reação de equilíbrio químico representada abaixo, que ocorre na atmosfera e envolve dois óxidos de nitrogênio:
N2O4(g) ⇌ 2NO2(g)
A partir de um experimento, foram registradas as variações das concentrações desses óxidos em função do tempo. Observe o gráfico:

Com base nos dados obtidos, o valor da constante de equilíbrio em função das concentrações é igual a:
a) 3,2 x 10-3
b) 4,8 x 10-3
c) 3,3 x 10-1
d) 4,0 x 10-1
3. (Espcex (Aman) 2023)
A aspirina é um medicamento antitérmico mundialmente conhecido e, em 2022, completou 123 anos desde o seu registro. O princípio ativo deste medicamento é o ácido acetilsalicílico, que é um ácido orgânico fraco.
Considere uma solução aquosa preparada por meio da dissolução de 18,0 g de ácido acetilsalicílico (100% de pureza) em 1,0 L de água, a 25 °C e 1 atm. A concentração de H+ nessa solução é igual a 5,70 x 10-3 mol/L.
Dados: log (5,7) = 0,76.
Fórmula molecular do ácido acetilsalicílico = C9H8O4
C = 12; H = 1; O = 16.
Baseado nestas informações, e considerando que a solução se encontra em equilíbrio químico, são feitas as seguintes afirmativas:
I. O valor da constante de acidez (Ka) é de 3,2 x 10-4, aproximadamente, nas condições descritas.
II. O pH da solução é aproximadamente 3,76.
III. A adição de ácido clorídrico deslocaria o equilíbrio no sentido do reagente.
IV. A adição de hidróxido de sódio à solução promoveria um aumento no valor do Ka.
Das afirmativas feitas, estão corretas apenas
a) I e III.
b) I e IV.
c) II e III.
d) II e IV.
e) III e IV.
4. (Fuvest 2023)
O processo de transporte de O2 para a respiração pode ser entendido como um processo de equilíbrio químico entre a hemoglobina (Hb) e o O2. A Hb é uma proteína do sangue responsável pelo transporte do O2 que também pode existir na forma protonada como HbH+. Dependendo da concentração de CO2, podem ocorrer a alcalose ou a acidose respiratória. A ligação do oxigênio com a HbH+ gera a forma oxigenada (HbO2), como pode ser representado pela equação química simplificada:
HbH+ (aq)+ O2 (g) ⇌ HbO2 (aq) + H+ (aq)
O dióxido de carbono liberado na respiração pode alterar esse equilíbrio devido à formação de ácido carbônico, representado pela equação:
CO2 (g)+ H2O(l) ⇌ H+ (aq) + HCO3– (aq)
Com base nessas informações, é correto afirmar:
a) Nos pulmões, onde a concentração de oxigênio é mais elevada, a forma de hemoglobina favorecida é a protonada.
b) Nos tecidos humanos, onde é consumido O2 pelo metabolismo, a forma de hemoglobina favorecida é a HbO2.
c) Quando uma pessoa expira mais depressa que o normal, a concentração de dióxido de carbono no seu sangue diminui e, nessas situações, a forma de hemoglobina favorecida é a forma protonada.
d) Nos tecidos humanos, onde é liberado dióxido de carbono produzido pelo metabolismo, a forma de hemoglobina favorecida é a forma protonada.
e) Nos tecidos humanos, onde é liberado dióxido de carbono produzido pelo metabolismo, a forma de hemoglobina favorecida é a HbO2.
5. (Fatec 2023)
O hidrogênio é matéria-prima fundamental na produção de produtos químicos como amônia, indispensável na indústria de fertilizantes. Na produção de amônia, temos o equilíbrio químico representado pela equação química:
N2 (g) + 3H2 (g) ⇌ 2NH3(g)
A expressão da constante de equilíbrio da produção de amônia é dada por:

Agora, considere a equação química que representa o equilíbrio químico da reforma a vapor do gás natural:
CH4 (g) + H2O (g) ⇌ 2H2 (g) + CO (g)
Desse modo, assinale a alternativa que contém a expressão correta da constante de equilíbrio para a transformação que ocorre na reforma a vapor do gás natural.

6. (Unesp 2023)
Quando cianeto de hidrogênio, um gás extremamente tóxico, é borbulhado em água, ocorre a produção de uma solução aquosa de ácido cianídrico, que se ioniza conforme a equação:
HCN (aq) ⇌ H+(aq) + CN– (aq)
Uma solução aquosa 0,2 mol/L de ácido cianídrico apresenta pH = 5 na temperatura de 25 °C. A partir desse dado, pode-se estimar o valor da constante Ka desse ácido nessa temperatura. Esse valor é, aproximadamente,
a) 1 x 10-10
b) 2 x 10-1
c) 5 x 10-10
d) 2 x 10-5
e) 5 x 10-1
7. (Fmc 2023)
A constante de equilíbrio é um valor que relaciona as concentrações das espécies reagentes e do produto no momento em que ocorre o equilíbrio. Kc representa o valor das constantes de equilíbrio em uma temperatura determinada, em função da concentração das espécies em mol L–1. Em caso da ocorrência da reação em fase gasosa, a constante é comumente expressa (Kp), em função das pressões parciais das espécies presentes no equilíbrio.
Para qual reação, os valores de Kp e Kc são idênticos?
a) 2NOCl (g) ⇌ 2NO (g) + Cl2(g)
b) N2(g) + 3H2(g) ⇌ 2NH3(g)
c) H2(g) Cl2(g) ⇌ 2HCl (g)
d) H2(g) + I2(s) ⇌ 2HI(g)
e) COCl2(g) ⇌ CO(g) + Cl2(g)
8. (Ita 2023)
Um eletrólito genérico BA2 ioniza em solução aquosa, de acordo com a equação química: BA2 ⇌ B2+ + 2A–
Solução 1: Volume V1, temperatura T1 e grau de ionização do eletrólito alfa1
Solução 2: Volume V2 = 2V1, temperatura T2 e grau de ionização do eletrólito alfa 2 = alfa 1
Com base nessas informações, assinale a opção que relaciona corretamente a constante de equilíbrio da ionização do eletrólito na solução 2, K2, com a constante de equilíbrio na solução 1, K1.
a) K2 = 0,25 K1.
b) K2 = 0,5 K1.
c) K2 = K1.
d) K2 = 2 K1.
e) K2 = 4 K1.
9. (Ufrgs 2023)
Para o ácido nitroso, HNO2, a constante de acidez vale 4,7 x 10-4.
A respeito desse ácido, considere as seguintes afirmações.
I. Uma solução aquosa de ácido nitroso tem pH alcalino.
II. A adição de nitrito de sódio à solução irá diminuir o seu pH.
III. Uma solução 1,0 mol L–1 de ácido nitroso exibirá uma concentração de H+ de cerca de 21,6 mmol.
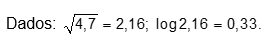
Quais estão corretas?
a) Apenas I.
b) Apenas II.
c) Apenas III.
d) Apenas II e III.
e) I, II e III.
10. (Ita 2023)
Os seguintes diagramas representam diferentes estados de equilíbrio de uma reação exotérmica do tipo A2(g) + B2(g) ⇌ 2AB(g)

Assinale a opção que contém a afirmação CORRETA.
a) Se a constante de equilíbrio da reação, Kc, em uma determinada temperatura, é igual a 3, apenas o diagrama (I) representa o sistema no equilíbrio.
b) Os diagramas (II) e (IV) podem representar a situação da reação em equilíbrio em duas temperaturas diferentes, com TII ˃ TIV.
c) Se todos os diagramas representam a reação em equilíbrio, o diagrama (III) representa a reação com a menor constante de equilíbrio.
d) Se a pressão for reduzida à metade pela duplicação do volume, em temperatura constante, os diagramas (II) e (III) representam a reação em equilíbrio para o estado inicial e final, respetivamente, desse processo, com VII = 2VIII.
e) Se cada símbolo que representa uma molécula nos diagramas equivale a 0,20 mol e se o volume do recipiente é 1,0 L, a constante de equilíbrio da reação representada pelo diagrama (I) é 0,5.
11. (Fmc 2023)
A constante de ionização da água (Kw), o potencial hidrogeniônico (pH) e o potencial hidroxiliônico (pOH) são medidas importantes para cálculos que envolvem equilíbrio químico em soluções ácidas e básicas, bem como na determinação da concentração dos íons H+ e OH– das soluções.
Em uma solução de uma substância A, de concentração 1.0 M e kb = 4,0 x 10-6, o pH e a [OH–] são respectivamente:
Dado: log2 = 0,3010.
a) 2.70 e 4,0 x 10-3 M
b) 10.30 e 4,0 x 10-3 M
c) 11.0 e 7,0 x 10-7 M
d) 2.40 e 7,0 x 10-7 M
e) 11.30 e 2,0 x 10-3 M
12. (Ufpa 2016)
O gráfico abaixo se refere ao comportamento da reação “A2(g) + B2(g) ⇌ 2AB(g) ”
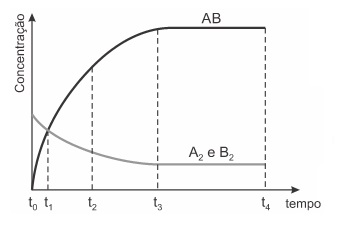
Pode-se afirmar que o equilíbrio dessa reação será alcançado quando o tempo for igual a
a) t0
b) t1
c) t2
d) t3
e) t4
Gabarito
Questão 1: A
Questão 2: B
Questão 3: A
Questão 4: D
Questão 5: D
Questão 6: C
Questão 7: C
Questão 8: A
Questão 9: C
Questão 10: B
Questão 11: E
Questão 12: D
Sugestões de vídeo:
TESTE – Questões formativas (2/2)
Questão 1 – pH
A concentração de íons OH– (aq) em determinada solução de hidróxido de amônio, a 25ºC é igual a 1 x 10-3 mol/L. O pOH dessa solução é
a) 0
b) 1
c) 3
d) 11
e) 13
Questão 2 – pH
O Potencial Hidrogeniônico, mais conhecido como pH, consiste num índice que indica a acidez, neutralidade ou alcalinidade de um meio qualquer. Os valores de pH variam de 0 a 14. As hortênsias são flores que se colorem obedecendo ao pH do solo. É como se o pH fosse o estilista desse tipo de flor. Em solos onde a acidez é elevada, as hortênsias adquirem a coloração azul, agora, nos solos alcalinos, elas ficam rosa. Fonte:
<http://mundoeducacao.bol.uol.com.br/quimica/o-ph-solo-coloracao-das-plantas.htm>.
Considerando as informações acima, em um solo com concentração de íons OH– de 10-12 mol/L o pH desse solo e a cor das hortênsias nele plantadas serão
a) 2,0 e cor rosa.
b) 2,0 e cor azul.
c) 12,0 e cor rosa.
d) 12,0 e cor azul.
Questão 3 – pH
O pH de uma solução cuja concentração hidroxiliônica é 1 x 10-4 mol/L é
a) 2
b) 4
c) 7
d) 9
e) 10
Questão 4 – pH
É CORRETOafirmar que o pH da água pura é:
a) 0
b) 1
c) 7
d) 10
Questão 5 – pH
Considere o produto iônico da água (Kw) a 25ºC = 1 x 10-14 (mol/L)2 e a concentração de íons H+ de um suco puro igual a 10-1 mol/L. Ao se preparar um refresco com 40 mL desse suco, adicionando água suficiente para completar 400 mL, o valor do pH obtido no refresco será igual a
a) 3.
b) 4.
c) 5.
d) 2.
e) 1.
Respostas:
Digite suas respostas no link:



