As ligações químicas são fundamentais para compreendermos como os átomos se unem para formar moléculas e compostos. Elas são responsáveis por determinar as propriedades e comportamentos dos materiais que nos cercam. Neste artigo, vamos explorar as principais características das ligações químicas, como elas funcionam e as regras que regem sua formação.
O que são Ligações Químicas?
As ligações químicas são forças atrativas que mantêm os átomos unidos. Os átomos buscam estabilidade eletrônica, ou seja, a configuração de elétrons semelhante à dos gases nobres (que possuem uma camada eletrônica externa completa). Para alcançar essa estabilidade, os átomos interagem uns com os outros compartilhando elétrons, doando ou recebendo elétrons.
Principais tipos de ligações químicas:
- Ligação iônica: ocorre entre átomos de elementos com diferença significativa de eletronegatividade. Nesse tipo de ligação, ocorre transferência de elétrons, resultando na formação de íons com cargas opostas que se atraem. Exemplo: NaCl (cloreto de sódio).
- Ligação covalente: ocorre entre átomos que compartilham elétrons para alcançar a estabilidade. Pode ser subdividida em:
a) Covalência não polar: os átomos compartilham os elétrons de forma igualitária. Exemplo: H₂ (gás hidrogênio).
b) Covalência polar: os átomos compartilham os elétrons de forma desigual, resultando em uma distribuição assimétrica de cargas. Exemplo: H₂O (água). - Ligação metálica: ocorre entre átomos de metais. Nesse tipo de ligação, os elétrons da camada de valência dos átomos estão livres para se mover entre eles, formando uma nuvem eletrônica. Essa mobilidade eletrônica confere aos metais suas propriedades características, como condutividade elétrica e térmica. Exemplo: Cobre metálico (Cu).
Regras das ligações químicas:
- Regra do octeto: a maioria dos átomos tende a ganhar, perder ou compartilhar elétrons para alcançar uma configuração eletrônica semelhante à dos gases nobres, que possuem oito elétrons na camada externa (exceto o hidrogênio, que busca dois elétrons). Essa regra explica a tendência dos átomos de formarem ligações para atingir essa estabilidade.
- Eletronegatividade: a diferença de eletronegatividade entre os átomos determina o tipo de ligação química que será formada. Quanto maior a diferença de eletronegatividade, maior a polaridade da ligação.
- Distribuição eletrônica: a distribuição eletrônica dos átomos nas ligações é determinada pelo princípio da exclusão de Pauli e pelo princípio da conservação da carga elétrica. Os elétrons ocupam orbitais de acordo com sua energia, preenchendo primeiro os níveis de menor energia.
- Geometria molecular: a disposição tridimensional dos átomos em uma molécula é determinada pela repulsão entre pares de elétrons. Essa repulsão busca maximizar a distância entre os elétrons, resultando em diferentes geometrias moleculares, como linear, angular, trigonal planar, tetraédrica, entre outras.
Vamos ver alguns exemplos:
Monte as fórmulas ligações iônicas:
a) Li F
b) Ca O
c) K S
d) Mg Br
e) Na N
f) Rb S
g) Cs O
h) Ba F
i) Ra Cl
j) Al S
k) Al Cl
l) Fe+2 Br
m) Fe+3 O
n) Ti+4 O
o) V+5 O
p) Fe+3 F
q) Ni+2 I
r) Zn+2 Cl
s) Au+3 Cl
t) Ag+ Br
u) Cu+ O
v) Cu+2 O
w) Au+3 O
x) Ti+4 Cl
y) Pd+2 Cl
z) Ir+3 Br
Gabarito das ligações iônicas:
a) Li+ F– fórmula: LIF
b) Ca+2 O-2 CaO
c) K+ S-2 K2S
d) Mg+2 Br– MgBr2
e) Na+ N-3 Na3N
f) Rb+ S-2 Rb2S
g) Cs+ O-2 Cs2O
h) Ba+2 F– BaF2
i) Ra+2 Cl– RaCl2
j) Al+3 S-2 Al2S3
k) Al+3 Cl– AlCl3
l) Fe+2 Br– FeBr2
m) Fe+3 O-2 Fe2O3
n) Ti+4 O-2 TiO2
o) V+5 O-2 V2O5
p) Fe+3 F– FeF3
q) Ni+2 I– NiI2
r) Zn+2 Cl– ZnCl2
s) Au+3 Cl– AuCl3
t) Ag+ Br– AgBr
u) Cu+ O-2 Cu2O
v) Cu+2 O-2 CuO
w) Au+3 O-2 Au2O3
x) Ti+4 Cl– TiCl4
y) Pd+2 Cl– PdCl2
z) Ir+3 Br– IrBr3
Sugestão de vídeos:
TESTE – Questões formativas (1/3)
Questão 1 – Ligação Química – parte 1/2
O selênio quando combinado com enxofre forma o sulfeto de selênio, substância que apresenta propriedades antifúngicas e está presente na composição de xampus anticaspa. Qual o tipo de ligação química existente entre os átomos de enxofre e selênio?
a) Covalente.
b) Dipolo-dipolo.
c) Força de London.
d) Iônica.
e) Metálica.
Questão 2 – Ligação Química – parte 1/2
Cinco amigos estavam estudando para a prova de Química e decidiram fazer um jogo com os elementos da Tabela Periódica:
– cada participante selecionou um isótopo dos elementos da Tabela Periódica e anotou sua escolha em um cartão de papel;
– os jogadores Fernanda, Gabriela, Júlia, Paulo e Pedro decidiram que o vencedor seria aquele que apresentasse o cartão contendo o isótopo com o maior número de nêutrons.
Os cartões foram, então, mostrados pelos jogadores.
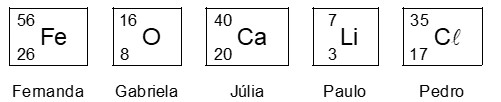
A ligação química que ocorre na combinação entre os isótopos apresentados por Júlia e Pedro é
a) iônica, e a fórmula do composto formado é CaCl
b) iônica, e a fórmula do composto formado é CaCl2
c) covalente, e a fórmula do composto formado é ClCa
d) covalente, e a fórmula do composto formado é Ca2Cl
e) covalente, e a fórmula do composto formado é CaCl2
Questão 3 – Ligação Química – parte 1/2
Os átomos se combinam através de ligações químicas buscando a estabilidade eletrônica. Existem três tipos de ligações químicas, sendo elas iônica, covalente e metálica. Diante da assertiva, os compostos CsCl e BaS são considerados substâncias
a) covalentes polares.
b) iônicas.
c) covalentes apolares.
d) metálicas.
e) coloidais.
Respostas:
Digite suas respostas no link: