Você já se perguntou como os químicos sabem a quantidade exata de reagentes e produtos que participam de uma reação química? Como eles podem prever o rendimento de uma síntese ou a pureza de uma substância? A resposta para essas questões está no cálculo estequiométrico, um dos assuntos mais importantes e recorrentes na química.
O cálculo estequiométrico é o estudo das relações quantitativas entre as espécies químicas que participam de uma reação. Ele se baseia nas leis ponderais e volumétricas, nas equações químicas balanceadas e nos conceitos de mol, massa molar e número de Avogadro. Com ele, é possível determinar a quantidade de matéria, a massa, o volume, a concentração ou a energia envolvidos em uma transformação química.
O cálculo estequiométrico é fundamental para a compreensão da química e para a sua aplicação prática em diversas áreas, como a indústria, a farmácia, a agricultura, a medicina e o meio ambiente. Por isso, ele é cobrado com frequência nos vestibulares, no Enem e nos concursos na área de química. Dominar esse assunto é essencial para garantir uma boa nota nessas provas e para se destacar no mercado de trabalho.
Neste post, você vai aprender como fazer cálculos estequiométricos de forma simples e eficiente. Você vai ver exemplos práticos, exercícios resolvidos e dicas para não errar nas questões. Você também vai assistir a um vídeo atualizado sobre o tema, que vai te ajudar a fixar o conteúdo. Vamos começar? 😊
O que é Cálculo Estequiométrico?
O cálculo estequiométrico é uma ferramenta fundamental para a química, porque permite determinar a quantidade de reagentes necessários para uma reação química, bem como a quantidade de produtos que serão gerados. Em outras palavras, o cálculo estequiométrico é como os químicos transformam a teoria em prática, e é uma das principais habilidades que qualquer estudante de química deve dominar. Portanto, não deixe de estudar cálculo estequiométrico, a menos que você não tenha desejo de estar entendendo química.
Por que é importante estudar Cálculo Estequiométrico?
O cálculo estequiométrico é uma habilidade importante para qualquer estudante de química, pois, permite que os estudantes compreendam as reações químicas e a relação entre os reagentes e produtos. Além disso, o cálculo estequiométrico é uma habilidade utilizada em muitas áreas da química, como na produção de produtos químicos, na análise de amostras, no desenvolvimento de novos materiais e no estudo de reações bioquímicas. Além disso, nos concursos públicos e vestibulares é um dos assuntos que possuem alta frequência nas cobranças.
Como realizar cálculos estequiométricos?
Para realizar cálculos estequiométricos, é necessário conhecer a estequiometria das reações químicas, ou seja, conhecer os índices estequiométricos. Portanto, a estequiometria é a relação entre as quantidades de reagentes e produtos envolvidos em uma reação química, que inicia com o balanceamento das equações, logo abaixo há um vídeo que ensino um método para realizar o balanceamento químico, chamei de método “MACHO”, acrônimo para Metal – Ametal – Carbono – Hidrogênio – Oxigênio. Como resultado, é necessário fazer um balanço de massa e utilizar as proporções estequiométricas entre os reagentes e produtos.
Veja o exemplo:

Veja o vídeo que mostro como realizar sistematicamente o balanceamento de reações químicas:
Às vezes o balanceamento pode ser um pouco mais complexo, você precisará fazer o balanceamento por óxido-redução:
Cálculo estequiométrico no ENEM
Esse assunto é muito importante para a química e costuma ser cobrado com frequência no ENEM e em outros vestibulares.
Para resolver um problema de cálculo estequiométrico, é preciso seguir alguns passos básicos:
- Identificar os dados fornecidos pelo enunciado, como massa, volume, concentração, número de mols ou de entidades de uma substância.
- Escrever a equação química que representa a reação, caso não esteja dada, e balanceá-la corretamente, usando coeficientes estequiométricos inteiros.
- Estabelecer a relação entre os dados fornecidos e os dados procurados, usando regras de três simples ou compostas, que envolvem as grandezas molares, massas molares, volumes molares e números de Avogadro.
- Efetuar os cálculos necessários, respeitando as unidades e os algarismos significativos, e apresentar o resultado com a unidade adequada.
Cálculo estequiométrico em soluções
O cálculo estequiométrico em soluções é um dos principais usos do cálculo estequiométrico na química, porque, permite determinar a quantidade de soluto e solvente necessários para produzir uma solução de uma determinada concentração. Além disso, o cálculo estequiométrico em soluções também é utilizado para determinar a quantidade de uma substância em uma amostra, utilizando técnicas analíticas como a titulação. Como resultado, a aplicação do cálculo estequiométrico em soluções pode ser processo da titulação, saiba mais no vídeo de titulação.
Cálculo Estequiométrico em reações em série
As reações em série são aquelas em que a reação química se desdobra em várias etapas, portanto, o cálculo estequiométrico em reações em série é utilizado para determinar a quantidade de reagentes e produtos em cada etapa da reação. Além disso, é importante para entender como a reação ocorre e para otimizar a produção de produtos químicos.
Cálculo Estequiométrico em reações reversíveis
A reação conhecida como a síntese da amônia é de extrema importância na produção de fertilizantes envolve uma reação química reversível para a formação de amônia (NH3) a partir de nitrogênio (N2) e hidrogênio (H2), e vice-versa. Em outras palavras, fatores de temperatura, pressão e concentração dos reagentes, podem afetar as reações reversíveis, pois permite otimizar processos industriais e obter um melhor controle sobre as reações químicas. Saiba mais sobre o equilíbrio na síntese do gás amônia no vídeo.
Cálculo estequiométrico nos vestibulares e ENEM nos últimos três anos (2023-2021)
Cálculo estequiométrico nos vestibulares e ENEM nos últimos três anos (2023-2021), por exemplo, o cálculo estequiométrico é um assunto comum em provas de química nos vestibulares. A estequiometria é a área da química que estuda as quantidades de reagentes e produtos envolvidos em uma reação química.

Vamos treinar em algumas questões dos vestibulares mais recentes:
1. (Acafe 2023)
Uma explosão devastadora em um porto de Beirute, na terça-feira, 4 de agosto de 2020, matou mais de 100 pessoas e feriu pelo menos 5.000. De acordo com relatos da imprensa local, o acidente parece ter ocorrido como resultado da combustão de uma substância denominada nitrato de amônio. As autoridades libanesas informaram que havia 2,7 mil toneladas de nitrato de amônio estocadas em uma unidade de armazenamento na região portuária da cidade.
Bertotti, Mauro. Jornal da USP. 06/08/2020, disponível em: https://jornal.usp.br/?p=344069.
O nitrato de amônio utilizado na fabricação de fertilizantes é obtido a partir da reação a seguir, com 90% de rendimento.
(NH4)2SO4 (aq) + Ca(NO3)2 (aq) → NH4NO3 (aq) + CaSO4 (s)
Determine a massa aproximada de nitrato de cálcio, com 75% de pureza, necessária para produzir a quantidade de sal que estava armazenada na região portuária de Beirute.
Dados: (NH4)2SO4 = 132 g/mol; Ca(NO3)2 = 164 g/mol; NH4NO3 = 80 g/mol; CaSO4 = 136 g/mol
a) 2768 toneladas
b) 4100 toneladas
c) 3075 toneladas
d) 1912 toneladas
2. (Pucrs Medicina 2023)
O clorofórmio (CHCl3) foi introduzido como anestésico em procedimentos cirúrgicos no século XIX, na Inglaterra. Entretanto, o seu uso foi gradativamente abandonado devido ao seu alto grau de toxicidade, sendo substituído por substâncias anestésicas mais adequadas. O clorofórmio pode ser preparado pela reação de metano com cloro:
CH4 (g) + 3 Cl2 (g) → CHCl3 (l) + 3 HCl (g)
A quantidade de cloro, em gramas, necessária para produzir 1,5 mol de clorofórmio é
Dado: Cl = 35,5 g/mol
a) 106
b) 155
c) 319
d) 350
3. (Unesp 2023)
O metal tungstênio, W (s), é produzido a partir do óxido de tungstênio(VI), WO3 (s), pela reação, em alta temperatura, desse óxido com hidrogênio, H2 (g). O outro produto dessa reação é a água no estado gasoso.

Sabendo que o volume molar de gás nas Condições Ambiente de Temperatura e Pressão (CATP) é igual a 25 L/mol, para cada mol de tungstênio que se forma nessa reação, o volume de hidrogênio que reage, medido nas CATP, é próximo de
a) 50 L.
b) 60 L.
c) 25 L.
d) 35 L.
e) 75 L.
4. (Unichristus – Medicina 2023)
O ácido acetilsalicílico (AAS) é um fármaco analgésico não esteroide de grande relevância mundial, sendo o composto orgânico mais produzido na indústria farmacêutica no mundo inteiro. Em escala industrial, esse composto pode ser obtido por meio da reação de acetilação do ácido salicílico (AS) com anidrido acético, catalisada por piridina, com rendimento de 50%, conforme representado a seguir.

Para a obtenção do referido ácido, em uma indústria, durante o primeiro trimestre, foram utilizadas 276 toneladas de ácido salicílico com 90% de pureza.
Considerando o mesmo desempenho industrial em todos os demais períodos do ano, a quantidade de ácido acetilsalicílico, em toneladas, produzida durante o período de um ano por essa indústria é de
Dados: massas molares: AS = 138 g/mol; AAS = 180 g/mol
a) 486.
b) 81.
c) 162.
d) 648.
e) 324.
5. (Integrado – Medicina 2023)
A Nifedipina pertence a um grupo de substâncias conhecidas como antagonistas do cálcio e é responsável por dilatar os vasos sanguíneos, diminuindo a resistência à passagem do sangue, o que proporciona uma diminuição da pressão. Quando usada no tratamento da pressão alta, esta diminui o risco de ocorrerem complicações no coração, no cérebro e nos vasos sanguíneos.
Disponível em https://www.bulario.com/nifedipina. Acesso em 13 de out. 2022.
A Nifedipina pode ser sintetizada via reação de Hantzsch, conforme o esquema a seguir.
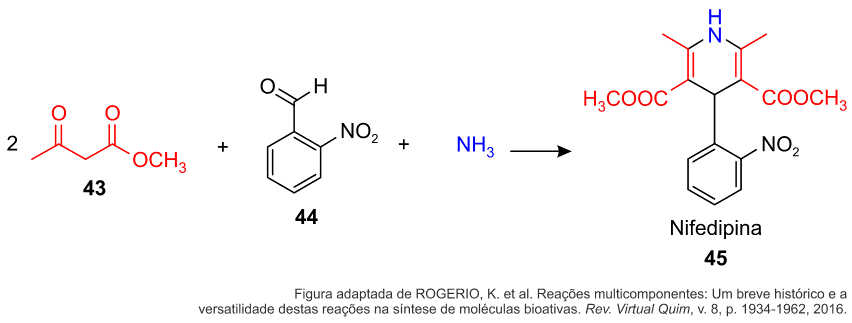
Partindo-se de 30 g gramas do reagente 43 (C5H8O3 – MM= 116 g/mol), e considerando a estequiometria da reação 2:1, qual a quantidade máxima de nifedipina (C17H18N2O6 – MM= 346 g/mol) que pode ser formada?
a) 8,5 g.
b) 20,1 g
c) 35,2 g.
d) 44,7 g.
e) 89,5 g.
6. (Pucpr Medicina 2023)
Leia o excerto a seguir, retirado do trabalho de conclusão de curso técnico em química industrial e processos industriais do centro estadual de educação profissional de Curitiba (CEEP).
O provável descobridor do ácido sulfúrico (H2SO4) foi o alquimista árabe Jabir ibn Hayyan, embora o médico e alquimista do século IX Ibn Zakariya al-Razi também seja, às vezes, mencionado. Este último obteve a substância pela formatação seca de sulfato de ferro (II) hepta-hidratado (FeSO4.7H2O), também chamado de vitriola verde, e o sulfato de cobre (II) penta-hidratado (CuSO4.5H2O) chamado de vitriola azul, que ao serem aquecidos decompõem-se levando a formação de uma solução diluída de ácido sulfúrico. Por isso, durante a época, o ácido sulfúrico ficou conhecido como óleo de vitriolo. (Siqueira et al.,2009)
[…]
Modernamente, pode-se afirmar que a produção industrial do ácido sulfúrico (H2SO4) ocorre em três etapas, de acordo com o esquema reacional a seguir.
1ª Etapa – Síntese do anidrido sulfuroso (rendimento 95%)
S (s) + O2 (g) → SO2 (g)
2ª Etapa – Síntese do anidrido sulfúrico (rendimento 60%)
SO2 (g) + ½ O2 → SO3 (g)
3ª Etapa – Reação do anidrido sulfúrico com água (rendimento 80%)
SO3 (g) + H2O (l) → H2SO4 (aq)
Em conformidade com as informações disponibilizadas no enunciado, pode-se afirmar que a massa aproximada de ácido sulfúrico obtida industrialmente a partir de 96 toneladas de enxofre sólido puro é igual a
Dados: H = 1; O = 16; S = 32.
a) 94,0 toneladas
b) 111,7 toneladas
c) 134,0 toneladas
d) 148,9 toneladas
e) 196,0 toneladas
7. (Fuvest 2023)
Combustíveis fósseis, como o diesel, contém em sua composição uma fração de enxofre. Durante o processo de combustão, o enxofre é convertido em SO2, tornando-se um poluente ambiental. Em postos de combustível, normalmente são comercializados dois tipos de diesel, o Diesel S10 e o Diesel S500. O primeiro contém 10 ppm de enxofre, e o segundo, 500 ppm de enxofre.
Considere que na combustão do diesel, todo enxofre seja convertido em SO2, conforme reação a seguir:
S (s) + O2 (g) → SO2 (g)
Nesse caso, a diferença de massa de SO2 emitido para a atmosfera por kg de diesel quando cada um dos dois tipos é queimado é de
Note e adote:
Massas molares (g/mol): O = 16; S = 32.
1 ppm de enxofre equivale a 1 mg de enxofre por kg de diesel
a) 245 mg/Kg
b) 490 mg/Kg
c) 980 mg/Kg
d) 1960 mg/Kg
e) 3920 mg/Kg
8. (Unifor – Medicina 2023)
Para se determinar o teor de ácido acetil salicílico (C9H8O4) num comprimido analgésico, 1,0 g de comprimido foi dissolvido em 40,0 mL de etanol. Essa solução consumiu 20,0 mL de uma solução aquosa de NaOH 0,25 mol/L para a reação completa de acordo com a seguinte reação:
C9H8O4 (aq) + NaOH (aq) → NaC9H7O4 (aq)
Logo o teor, em massa, de ácido acetil salicílico será de:
Dados: C = 12; H = 1; O = 16.
a) 55,0%
b) 67,0%
c) 80,0%
d) 90%
e) 97,0%
9. (Unip – Medicina 2023)
Os produtos obtidos na eletrólise de uma solução aquosa de cloreto de sódio (NaCl) são o cloro (Cl2), a soda cáustica (NaOH) e o hidrogênio (H2).
A equação que representa esse processo está indicada a seguir.
2 NaCl (s) + 2H2O (l) → 2 NaOH (aq) + H2 (g) + Cl2 (g)
Em uma indústria, meia tonelada de cloro foi produzida a partir da eletrólise de 1,17 t de cloreto de sódio. O rendimento do processo industrial é, aproximadamente, igual a
Dados: Na = 23; Cl = 35,5
a) 85%.
b) 70%.
c) 26%.
d) 30%.
e) 35%.
10. (Ufpr 2023)
A elevação da concentração de fosfato em rios e lagos causa poluição e outros problemas ambientais, como a eutrofização. Assim, o monitoramento da concentração de fosfato é de interesse ambiental e pode ser realizado por meio de teste colorimétrico, explorando a reação de azul de molibdênio. Ao adicionar o íon molibdato (MoO42-), ácido mineral e um agente redutor numa amostra de água contendo fosfato, forma-se o composto de intensa cor azul. A intensidade de cor da solução neste teste é proporcional à concentração de fosfato na amostra.
A reação química envolvida entre o íon fosfato e molibdato no teste é descrita pela seguinte equação:
PO43- +12 MoO42- + 27H+ → H3PMo12O40 + 12H2O
Nesse teste, a quantidade de matéria de MoO42- necessária para uma amostra de 10 mL contendo 2 mg L-1 de H3PO4 (98 g mol-1) é mais próxima de:
Dados: 1 mg = 10-3 g; 1 mL = 10-3 L
a) 1,0 x 10-3 mol
b) 0,25 x 10-3 mol
c) 0,02 x 10-3 mol
d) 2,4 x 10-6 mol
e) 0,2 x 10-6 mol
11. (Unicamp 2023)
Texto 1
A Química Verde é uma área multidisciplinar que cria, desenvolve e aplica produtos e processos químicos que visam à redução ou eliminação do uso e da geração de substâncias nocivas ao meio ambiente e ao homem. Em 2019, para reunir várias ações relativas à Química Verde, os pesquisadores Paul T. Anastas e Julie B. Zimmerman propuseram a Tabela Periódica dos Elementos Figurativos da Química Verde e Sustentável – TPQVS (figura abaixo). Assim como na Tabela Periódica dos Elementos Químicos, a TPQVS apresenta “elementos”, os quais, porém, representam ações associadas aos preceitos da Química Verde, sendo que cada grupo (G) da TPQVS reúne ações com os mesmos preceitos.

Texto 2
“A Química é pura beleza;
Os átomos e as moléculas são a realeza,
reagindo no compasso da natureza
para transformar o mundo com delicadeza.
Sou um simples menestrel da ciência
que defende suas ideias com veemência.
Como Químico, quero atuar com sapiência,
desenvolvendo processos de alta eficiência.
A Química não é mais poluição;
para o fóssil ela tem a substituição;
renovando o verde como solução.
Vivemos num tempo de ambiguidade,
onde a terra, a água e o ar estão em vulnerabilidade.
Façamos da Química o caminho para a sustentabilidade”
(MOTA, Claudio J. A. Conferência de Abertura da 45ª. Reunião Anual da Sociedade Brasileira de Química, 2022.)
Um dos princípios da Química Verde, ilustrado por um dos grupos na TPQVS (texto I), é a economia atômica, dada pela razão da massa do produto de interesse pela massa total dos reagentes, sendo que quanto mais próximo de 1 é seu valor, maior é a economia atômica. Considerando as reações de produção dos dois principais biocombustíveis utilizados no contexto brasileiro,
Síntese do biodiesel:
C57H104O6 + 3C2H5OH — 2C20H38O2 + C3H8O3
Síntese do etanol:
C12H22O11 + H2O → 4C2H5OH + 4CO2
pode-se afirmar que há uma maior economia de átomos e
Dados de Massa Molar (g/mol): C57H104O6 = 884; C2H5OH = 46; C20H38O2 = 310; C3H8O3 = 92; C12H22O11 = 342; H2O = 18; CO2 = 44.
a) maior geração de subprodutos (mol de subprodutos/ mol de substrato) na síntese do etanol.
b) menor geração de subprodutos (mol de subprodutos/ mol de substrato) na síntese do etanol.
c) maior geração de subprodutos (mol de subprodutos/ mol de substrato) na síntese do biodiesel.
d) menor geração de subprodutos (mol de subprodutos/ mol de substrato) na síntese do biodiesel.
12. (Unesp 2022)
Considere a fórmula do sal lactato de cálcio hidratado, empregado como repositor de cálcio.

Quando aquecido a 120 °C, o sal hidratado transforma-se no sal anidro. Em um experimento, 30,8 g de lactato de cálcio hidratado foram aquecidos, originando 21,8 g de sal anidro.
Logo, o valor de x na fórmula apresentada é igual a
Dados: H = 1; C = 12; O = 16; Ca = 40.
a) 3.
b) 5.
c) 1.
d) 2.
e) 4.
13. (Unesp 2022)
O limão “Tahiti”, por não apresentar sementes e ter suco abundante, com elevado teor de ácido cítrico C3H5O(COOH)3 pode ser fonte desse ácido puro obtido no estado sólido. A primeira etapa dessa obtenção consiste na precipitação do ácido cítrico presente no suco do limão, como citrato de cálcio Ca3[C3H5O(COO)3]2 por adição de solução aquosa saturada de hidróxido de cálcio Ca(OH)2 ao suco, conforme a reação:
2 C3H5O(COOH)3 (aq) + 3 Ca(OH)2 (aq) → Ca3[C3H5O(COO)3]2 (s) + 6 H2O (l)
Considere que:
– nessa reação foram obtidos 640 g de citrato de cálcio;
– as massas molares do citrato de cálcio e do ácido cítrico são, respectivamente, 498 g/mol e 192 g/mol;
– o rendimento da reação é 100%;
– cada limão “Tahiti” apresenta em média 2,5 g de ácido cítrico.
De acordo com as informações, o número de limões “Tahiti” necessários para obter os 640 g de citrato de cálcio foi próximo de
a) 200.
b) 300.
c) 500.
d) 700.
e) 800.
14. (Fatec 2017)
Cinco amigos estavam estudando para a prova de Química e decidiram fazer um jogo com os elementos da Tabela Periódica:
– cada participante selecionou um isótopo dos elementos da Tabela Periódica e anotou sua escolha em um cartão de papel;
– os jogadores Fernanda, Gabriela, Júlia, Paulo e Pedro decidiram que o vencedor seria aquele que apresentasse o cartão contendo o isótopo com o maior número de nêutrons.
Os cartões foram, então, mostrados pelos jogadores.
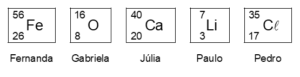
Os isótopos representados contidos nos cartões de Paulo e Gabriela podem reagir entre si para formar óxido de lítio, segundo a reação balanceada
4 Li (s) + O2 (g) → 2 Li2O (s)
A massa de lítio necessária para reagir completamente com 3,2 Kg de oxigênio é, em quilogramas,
Massas molares: Li = 7 g/mol e O = 16 g/mol
a) 1,4
b) 1,8
c) 2,8
d) 4,3
e) 7,1
15. (UFPA 2016)
Fósforo branco (P4) pode ser produzido segundo a equação química (não balanceada) dada abaixo:
Ca3(PO4)2 + SiO2 + C → P4 + CaSiO3 + CO
Considerando que a reação é 100% eficiente, o número de mols de CO liberados para cada mol de P4 produzido será de
a) 1
b) 5
c) 10
d) 15
e) 20
16. (IFSUL 2016)
Células a combustível de hidrogênio-oxigênio são usadas no ônibus espacial para fornecer eletricidade e água potável para o suporte da vida. Sabendo que a reação da célula ocorre conforme reação não balanceada H2 (g) + O2 (g) → H2O (l), qual é o número de mols de água formado na reação de 0,25 mol de oxigênio gasoso com hidrogênio suficiente?
a) 0,25 mol
b) 0,50 mol
c) 0,75 mol
d) 1 mol
17. (IFCE 2016)
Dada a reação não balanceada H2 (g) + O2 (g) → H2O (l) é correto afirmar-se que a massa de água produzida na queima de 40 Kg de hidrogênio e a massa de oxigênio consumidos na reação são, respectivamente,
(Dados de massa molar (g/mol): H = 1 e O =16)
a) 320 Kg e 360 Kg
b) 360 Kg e 320 Kg
c) 360 Kg e 80 Kg
d) 320 Kg e 80 Kg
e) 160 Kg e 80 Kg
Gabarito
1.[B] 2.[C] 3.[E] 4.[D] 5.[D] 6.[C] 7.[C] 8.[D] 9.[B] 10.[D] 11.[D] 12.[B] 13.[A] 14.[C] 15.[C] 16.[B] 17.[B]
Vídeos que podem ajudar a compreender melhor o conteúdo de cálculo estequiométrico.
Nesse vídeo falo sobre balanceamento e nox, questão abordada na UNIFESP 2017 2º dia. O cloreto de alumínio anidro, AℓCℓ3(s), tem grande importância para a indústria química, pois é empregado como catalisador em diversas reações orgânicas. Esse composto pode ser obtido pela reação química entre cloro gasoso, Cℓ2(g), e alumínio metálico, Aℓ (s).
a) Indique como variam os números de oxidação do cloro e do alumínio nessa reação e qual desses reagentes atua como agente redutor.
b) Escreva a equação balanceada dessa reação química.
O sódio e o cloro reagem formando o cloreto de sódio: 2 Na(s) + Cl2(g) → 2 NaCl(s) Qual é o rendimento teórico de cloreto de sódio para a reação de 55,0 g de Na com 67,2 g de Cl2?
A cinética química está associado a estequiometria, veja nesse exemplo da questão do vestibular da Universidade Federal de Juiz de Fora (UFJF – 2021). Quando o ferro metálico entra em contato com ácido clorídrico (HCl), à temperatura constante, reage rapidamente formando o gás hidrogênio (H2), como é indicado pela equação: 2Fe(s) + 6 HCl(aq) = 2FeCl3(aq) + 3 H2(g) Sabendo-se que em 30 segundos de reação foram consumidos 12 mol de HCl, qual o número de mols do gás hidrogênio (H2) produzidos em 5 minutos?
a) 60 mol
b) 30 mol
c) 6 mol
d) 18 mol
e) 11 mol
Vamos estudar o cálculo estequiométrico? O óxido de manganês(IV) reage com o alumínio formando manganês elementar e óxido de alumínio: 3 MnO2 + 4 Al → 3 Mn + 2 Al2O3 Qual é a massa de Al necessária para reagir completamente com 25,0 g de MnO2?
Nesse vídeo é abordado de forma simples o conceito fundamental do cálculo estequiométrico, que envolve a definição de reagentes e produtos, escrever a equação química e um breve balanceamento com o uso do método “MACHO”. Em próximo vídeo abordaremos o cálculo estequiométrico com cálculos.
TESTE – Questões formativas (1/3)
Questão 1 – Estequiometria
O nitrogênio forma vários óxidos. Um deles, o óxido nitroso (N2O), conhecido como gás hilariante, descoberto pelo aprendiz farmacêutico inglês Humphry Davy (1778–1829), apresenta massa molecular igual a
Dados: N = 14; O = 16.
a) 60.
b) 30.
c) 44.
d) 46.
Questão 2 – Estequiometria
Uma massa de 44 g de CO2 corresponde a 1,0 mol de CO2 e ocupa, nas CNTP, um volume fixo de 22,4 L. Desse modo, assinale a alternativa que apresenta, aproximadamente, o volume ocupado por 188g de gás carbônico (CO2).
a) 90L
b) 80L
c) 44L
d) 96L
e) 22L
Questão 3– Estequiometria
Vidros de vasilhames contêm cerca de 80% de SiO2em sua composição. Assim, considerando esse percentual, é correto afirmar que, em 525 g de vidro de vasilhame, a quantidade de matéria de SiO2 é:
a) 4 mol
b) 14 mol
c) 7 mol
d) 3 mol
e) 9 mol
Questão 4 – Estequiometria
Em uma partida de futebol, um atleta gasta cerca de 720 kcal, o que equivale a 180 g do carboidrato C3H6O3. A partir dessas informações, é correto afirmar que essa quantidade de carboidrato corresponde a:
a) 2 mol
b) 1 mol
c) 3 mol
d) 0,5 mol
e) 4 mol
Questão 5 – Estequiometria
Dada a reação não balanceada H2 + O2 → H2O, é correto afirmar-se que a massa de água produzida na queima de 40 Kg de hidrogênio e a massa de oxigênio consumidos na reação são, respectivamente,
a) 320 Kg e 360 Kg
b) 360 Kg e 320 Kg
c) 360 Kg e 80 Kg
d) 320 Kg e 80 Kg
e) 160 Kg e 80 Kg
Questão 6 – Estequiometria
A Estação Espacial Internacional (EEI) é um satélite artificial habitável que orbita nosso planeta a 422Km de altitude. Desde 02 de novembro de 2000, data da chegada dos primeiros astronautas a esta estação, a EEI vem batendo recordes, pois está continuamente habitada. Devido ao processo de respiração, um astronauta elimina diariamente cerca de 470 litros de gás carbônico (nas CNTP). Suponha que se utilizem filtros contendo hidróxido de sódio para absorver o CO2 e transformá-lo em carbonato de sódio e água. Assinale a alternativa que apresenta a quantidade de massa de hidróxido de sódio necessária para que este astronauta permanecesse 07 (sete) dias nesta estação espacial.
a) 11,75 Kg
b) 839 g
c) 1,68 Kg
d) 5,40 Kg
e) 240g
Questão 7 – Estequiometria
A bauxita é um minério utilizado na extração do alumínio, obtido através de processos metalúrgicos como a eletrólise ígnea. Antigamente, o alumínio era um metal muito raro, devido ao método ineficiente de sua extração, feita a partir da reação da alumina, óxido de alumínio, com o ácido clorídrico, seguido da adição de potássio, conforme descrito abaixo.
Al2O3 (s) + 6 HCl (aq) → 2 AlCl3 (aq) + 3 H2O (l)
AlCl3 (aq) + 3 K (s) → 3 KCl (s) + Al (s)
Dispondo do método antigo para comparação de resultados, uma metalúrgica verificou que nesse processo havia 75% de rendimento, ao empregar 330,0 kg de alumina.
Sendo assim, a massa de alumínio extraída, em kg, é de, aproximadamente,
Dados: O = 16 g/mol; Al = 27 g/mol.
a) 65,0
b) 87,0
c) 120,5
d) 131,0
e) 145,3
Questão 8 – Estequiometria
Vários métodos têm sido empregados para a captura de CO2 na atmosfera, com o objetivo de diminuir os danos causados pelo efeito estufa, como, por exemplo, a produção de ácido oxálico, o qual pode ser utilizado posteriormente para obtenção de compostos de alto valor agregado. Uma das rotas possíveis é a de um processo eletroquímico cuja reação total é
2 CO2 (g) + H2O (l) → H2C2O4 (aq) + ½ O2 (g)
Considerando que o CO2 se comporta como um gás ideal nas CNTP, a quantidade de CO2 nessas condições, retirado da atmosfera para produção de 900 g de ácido oxálico, é, em L, aproximadamente de
Dados: H = 1; C = 12; O = 16.
a) 44.
b) 88.
c) 224.
d) 448.
e) 880.
Questão 9 – Estequiometria
O paracetamol (C8H9NO2, massa molar: 151,16 g/mol) foi sintetizado pela primeira vez em 1878 pelo químico americano Harmon Northrop Morse; em 1887 esse fármaco foi usado como medicamento pelo médico alemão Joseph von Mering para tratamento de febre e de dores leve e moderada. O paracetamol é sintetizado através do p-aminofenol (C6H7NO, massa molar: 109,13 g/mol) e do anidrido acético (C4H6O3, massa molar: 102, 09 g/mol) com um rendimento de 65%.
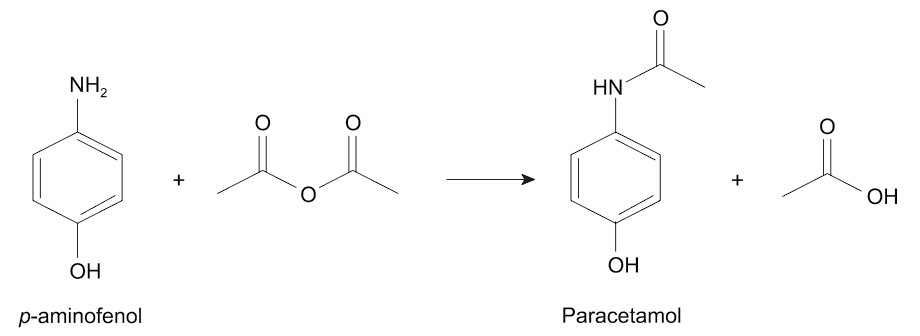
Considerando que uma indústria farmacêutica precisa preparar um lote com 1 milhão de comprimidos com 750 mg de paracetamol, qual é a massa de p-aminofenol, em kg, que deve ser utilizada para a produção dessa quantidade de comprimidos?
a) 633,02 kg.
b) 733,02 kg.
c) 833,02 kg.
d) 933,02 kg.
e) 1.033,02 kg.
Questão 10 – Estequiometria
Gases do efeito estufa, entre eles o CO2, em condições controladas, são essenciais à manutenção do clima na Terra. Porém, a explosão demográfica, os desmatamentos, as queimadas – como as da floresta amazônica e as do cerrado pantaneiro –, e a queima de combustíveis fósseis têm contribuído para o rápido aumento dos níveis de CO2 na atmosfera, e consequentemente para o contínuo desequilíbrio climático. Com relação ao que resulta da combustão completa de um mol de gasolina (C8H18), ainda um dos combustíveis fósseis mais utilizados mundialmente, é correto afirmar que são produzidos:
Dados: C = 12; O = 16.
a) 352 g de CO2 e 288 g de H2O.
b) 704 g de CO2 e 144 g de H2O.
c) 528 g de CO2 e 288 g de H2O.
d) 352 g de CO2 e 162 g de H2O.
e) 528 g de CO2 e 216 g de H2O.
Respostas:
Digite suas respostas no link:
https://forms.gle/RJfzxiMLeRsv8fDw6



