Olá, pessoal! Hoje eu trago para vocês um vídeo muito especial sobre um assunto que muitas vezes passa despercebido, mas que tem tudo a ver com a nossa vida: as interações intermoleculares. Neste vídeo, eu vou explicar o que são essas forças invisíveis que mantêm as moléculas unidas e como elas determinam as propriedades físicas das substâncias que nos cercam. Além disso, eu vou mostrar alguns exemplos práticos e curiosos de como as interações intermoleculares afetam o nosso cotidiano, como a formação de gotas de água no orvalho, a adesão da cola na superfície dos objetos, a flutuação dos navios na água, entre outros. Você não pode perder esse vídeo incrível que vai te fazer ver a química de uma forma diferente e divertida!
Ligações Químicas
Mas antes de entrarmos no assunto das interações intermoleculares, eu preciso revisar com vocês alguns conceitos básicos sobre as ligações químicas, que são as forças que mantêm os átomos unidos. Existem três tipos principais de ligações químicas: iônicas, metálicas e covalentes. As ligações iônicas ocorrem entre átomos que têm grande diferença de eletronegatividade, ou seja, de tendência a atrair elétrons. Nesse caso, um átomo doa um ou mais elétrons para outro átomo, formando íons de cargas opostas que se atraem eletrostaticamente. As ligações iônicas geram compostos iônicos, que têm estrutura cristalina e alta temperatura de fusão e ebulição. Um exemplo de composto iônico é o cloreto de sódio (NaCl), o sal de cozinha.
As ligações metálicas ocorrem entre átomos de metais, que têm baixa eletronegatividade e tendem a perder elétrons. Nesse caso, os átomos se unem formando uma rede tridimensional, na qual os elétrons mais externos ficam livres para se movimentar pelo retículo metálico. Esses elétrons são chamados de elétrons de valência ou elétrons livres, e são responsáveis pelas propriedades dos metais, como a condutividade elétrica e térmica, o brilho metálico e a maleabilidade. Um exemplo de metal é o ferro (Fe), que é usado na construção civil e na indústria.
As ligações covalentes ocorrem entre átomos que têm eletronegatividades semelhantes ou iguais, ou seja, que não têm tendência a doar ou receber elétrons. Nesse caso, os átomos compartilham um ou mais pares de elétrons entre si, formando moléculas. As ligações covalentes podem ser simples, duplas ou triplas, dependendo do número de pares de elétrons compartilhados. As ligações covalentes geram compostos moleculares, que têm estrutura discreta e baixa temperatura de fusão e ebulição. Um exemplo de composto molecular é a água (H2O), que é essencial para a vida.
Polaridade das moléculas
A polaridade das moléculas é uma propriedade que depende da distribuição dos elétrons nas ligações entre os átomos que formam a molécula. Uma molécula é polar quando há uma diferença de eletronegatividade entre os átomos ligados, ou seja, quando um átomo atrai mais os elétrons da ligação do que o outro. Isso gera uma separação de cargas parciais na molécula, sendo que um lado fica com carga parcial negativa (δ-) e o outro com carga parcial positiva (δ+). Uma molécula é apolar quando não há diferença de eletronegatividade entre os átomos ligados, ou seja, quando os elétrons da ligação são compartilhados igualmente. Isso faz com que a molécula não tenha polos definidos e seja eletricamente neutra.
A eletronegatividade é a capacidade de um átomo de atrair os elétrons de uma ligação química para si. A eletronegatividade dos elementos varia na tabela periódica de acordo com o número atômico, o raio atômico e a geometria molecular. Uma forma de memorizar a ordem de eletronegatividade dos ametais (elementos que tendem a ganhar elétrons e formar ânions) é usar a seguinte frase:
Fui Ontem No Clube, Briguei I Saí Correndo Para o Hospital
A letra inicial de cada palavra corresponde ao símbolo dos elementos na exata ordem em que aparecem na fila de reatividade:
F > O > N > Cl ~ Br ~ I > S ~ C ~ P ~ H
> simbolo de maior
~ simbolo de próximo
Para determinar a polaridade de uma molécula, podemos usar dois critérios: a eletronegatividade dos átomos e a geometria molecular. A eletronegatividade é a capacidade de um átomo de atrair os elétrons de uma ligação para si. Quanto maior a eletronegatividade de um átomo, maior será a sua tendência de puxar os elétrons da ligação. A geometria molecular é a forma como os átomos se organizam no espaço tridimensional. A geometria molecular influencia na polaridade porque determina como os vetores momento dipolar se somam na molécula. O vetor momento dipolar é uma seta que indica para qual átomo os elétrons da ligação estão se deslocando.
Vamos ver alguns exemplos de como aplicar esses critérios para determinar a polaridade das moléculas:
- Moléculas diatômicas homonucleares: são moléculas formadas por dois átomos do mesmo elemento químico, como H2, O2, N2, Cl2, etc. Essas moléculas são sempre apolares, pois não há diferença de eletronegatividade entre os átomos ligados. Os elétrons da ligação são compartilhados igualmente e não há formação de polos na molécula.
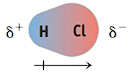
- Moléculas diatômicas heteronucleares: são moléculas formadas por dois átomos de elementos químicos diferentes, como HF, HCl, CO, NO, etc. Essas moléculas são sempre polares, pois há diferença de eletronegatividade entre os átomos ligados. Os elétrons da ligação são atraídos pelo átomo mais eletronegativo, gerando uma separação de cargas na molécula. O átomo mais eletronegativo fica com carga parcial negativa e o outro com carga parcial positiva.
- Moléculas triatômicas ou maiores: são moléculas formadas por três ou mais átomos, como H2O, CO2, NH3, CH4, etc. Essas moléculas podem ser polares ou apolares, dependendo da combinação da eletronegatividade dos átomos e da geometria molecular. Para determinar a polaridade dessas moléculas, devemos analisar cada ligação entre os átomos e somar os vetores momento dipolar resultantes. Se a soma dos vetores for zero, a molécula é apolar; se for diferente de zero, a molécula é polar.
Veja alguns exemplos:
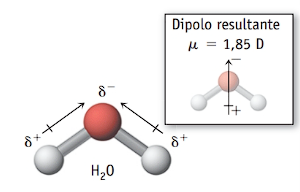
- H2O: a molécula de água tem geometria angular e duas ligações polares entre o oxigênio (mais eletronegativo) e os hidrogênios (menos eletronegativos). Os vetores momento dipolar não se anulam na molécula e resultam em um vetor resultante diferente de zero. Portanto, a molécula de água é polar.
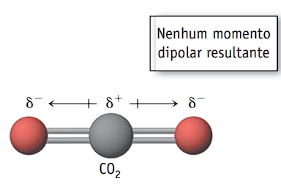
- CO2: a molécula de dióxido de carbono tem geometria linear e duas ligações polares entre o carbono (menos eletronegativo) e os oxigênios (mais eletronegativos). Os vetores momento dipolar se anulam na molécula e resultam em um vetor resultante igual a zero. Portanto, a molécula de dióxido de carbono é apolar.
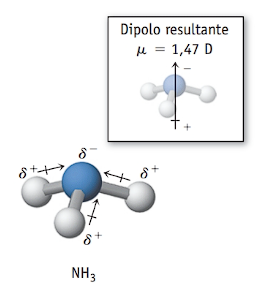
- NH3: a molécula de amônia tem geometria piramidal e três ligações polares entre o nitrogênio (mais eletronegativo) e os hidrogênios (menos eletronegativos). Os vetores momento dipolar não se anulam na molécula e resultam em um vetor resultante diferente de zero. Portanto, a molécula de amônia é polar.
Outros exemplos:

Interações intermoleculares
Agora que você já sabe o que são as ligações químicas e como elas se formam, vamos falar sobre as interações intermoleculares, que são as forças que mantêm as moléculas unidas. Essas forças são muito mais fracas do que as ligações químicas, mas são muito importantes para explicar as propriedades físicas das substâncias moleculares. Existem quatro tipos principais de interações intermoleculares: dipolo-dipolo, dipolo induzido-dipolo induzido (ou dispersão de London), dipolo induzido-dipolo permanente (ou Debye) e ligação de hidrogênio. Eu vou explicar cada uma delas no próximo vídeo.
As moléculas polares interagem entre si por meio de diferentes tipos de forças intermoleculares, que são classificadas em ordem crescente de intensidade:
- Forças de London ou dipolo induzido: são as forças de interações intermoleculares mais fracas e ocorrem entre todas as moléculas, polares ou apolares. Elas são causadas por flutuações momentâneas na distribuição dos elétrons, que geram dipolos instantâneos nas moléculas. Esses dipolos induzem outros dipolos nas moléculas vizinhas, criando uma atração fraca e temporária. Exemplos: H2, O2, N2, CH4.

- Forças dipolo-dipolo: são as forças que ocorrem entre moléculas polares permanentes. Elas são causadas pela atração eletrostática entre os polos opostos das moléculas. A extremidade negativa do dipolo de uma molécula se orienta na direção da extremidade positiva do dipolo de outra molécula. Exemplos: HCl, HBr, HI, CO.
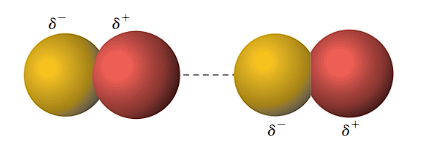
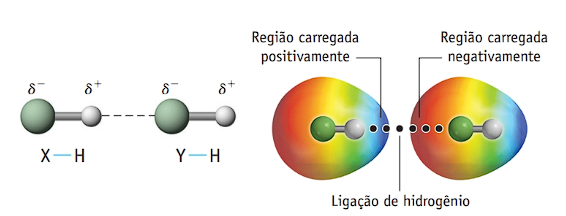
- Forças de hidrogênio ou pontes de hidrogênio: são as forças mais fortes e ocorrem entre moléculas polares que possuem hidrogênio ligado diretamente a átomos muito eletronegativos, como flúor, oxigênio ou nitrogênio. Esses átomos atraem fortemente os elétrons da ligação com o hidrogênio, deixando-o com uma carga parcial positiva muito alta. Esse hidrogênio se liga ao par de elétrons não compartilhado do átomo eletronegativo de outra molécula, formando uma ponte de hidrogênio. Exemplos: H2O, HF, NH3.
As moléculas apolares interagem entre si apenas por meio das forças de London, que são muito fracas. Por isso, elas têm baixos pontos de fusão e ebulição e tendem a ser gases nas condições ambientes.
Suponha que você tenha uma mistura de iodo sólido, I2, e os líquidos água e tetracloreto de carbono (CCl4). Que forças intermoleculares existem entre cada par possível de compostos?
A molécula apolar de iodo, I2, é facilmente polarizada e o iodo pode interagir com moléculas pola-res de água por forças dipolo-dipolo induzido e forças de dispersão de London. O tetracloreto de carbono apolar só pode interagir com o iodo apolar por forças de dispersão de London. A água e o CCl4 podem interagir por forças di-polo-dipolo induzido e forças de dispersão de London.
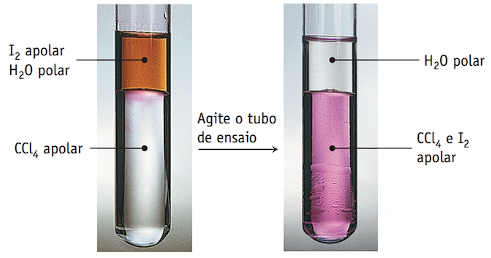
As fotografias aqui mostram o resultado da mistura desses três com-postos. Uma pequena quantidade de iodo dissolve-se em água para formar uma solução marrom. Quando se acrescenta essa solução marrom a um tubo de ensaio contendo CCl4 seja, são imiscíveis (a água polar não se dissolve em CCl4 apolar). Observe que a camada mais densa de CCl4 1,58 g/mL está abaixo da camada de água, menos densa. Quando agitamos o tubo de ensaio, o I2 extraído pelo CCl4 apolar, conforme indica o desaparecimento da cor de I2 aparecimento da cor roxa do I2 na camada de CCl4 (fundo).
Veja o vídeo de interações intermoleculares:
Algumas referências de vídeos:
O vídeo é muito educativo e divertido, e eu recomendo que você assista se você quer aprender mais sobre esse assunto fascinante.
O vídeo acima é sobre as interações intermoleculares que envolvem as interações químicas existentes nas bases nitrogenadas do DNA, questão que caiu no vestibular da UERJ 2015.
Se você precisar recordar sobre polaridade das moléculas, na live acima, apresento as formas que podem ser utilizadas para determinar a polaridade das moléculas. No vídeo faço a resolução de 7 questões, entre os vestibulares IFSUL 2019, CFMG 2019, UERJ 2018, UPF 2018, UNICAMP 2017 e ACAFE 2015.
Questão 1 (ENEM 2019)
A fluidez da membrana celular é caracterizada pela capacidade de movimento das moléculas componentes dessa estrutura. Os seres vivos mantêm essa propriedade de duas formas: controlando a temperatura e/ou alterando a composição lipídica da membrana. Neste último aspecto, o tamanho e o grau de insaturação das caudas hidrocarbônicas dos fosfolipídios, conforme representados na figura, influenciam significativamente a fluidez. Isso porque quanto maior for a magnitude das interações entre os fosfolipídios, menor será a fluidez da membrana.
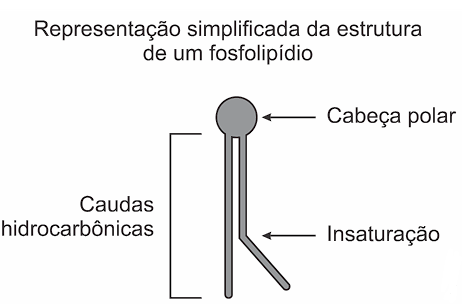
Assim, existem bicamadas lipídicas com diferentes composições de fosfolipídios, como as mostradas de I a V.

Qual das bicamadas lipídicas apresentadas possui maior fluidez?
a) I
b) II
c) III
d) IV
e) V
Questão 2 (ENEM 2020)
A obtenção de óleos vegetais, de maneira geral, passa pelas etapas descritas no quadro.
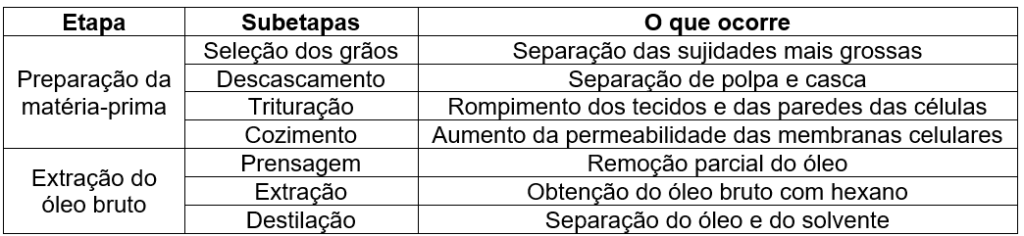
Qual das subetapas do processo é realizada em função apenas da polaridade das substâncias?
a) Trituração.
b) Cozimento.
c) Prensagem.
d) Extração.
e) Destilação.
Questão 3 (ENEM 2019)
Os hidrocarbonetos são moléculas orgânicas com uma série de aplicações industriais. Por exemplo, eles estão presentes em grande quantidade nas diversas frações do petróleo e normalmente são separados por destilação fracionada, com base em suas temperaturas de ebulição.
O quadro apresenta as principais frações obtidas na destilação do petróleo em diferentes faixas de temperaturas.
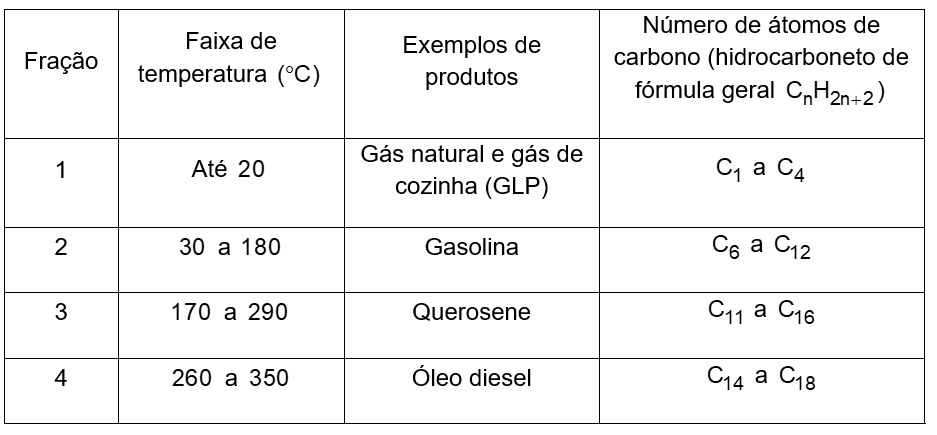
| SANTA MARIA, L. C. et al. Petróleo: um tema para o ensino de química. Química Nova na Escola, n.15, maio 2002 (adaptado). |
Na fração 4, a separação dos compostos ocorre em temperaturas mais elevadas porque
a) suas densidades são maiores.
b) o número de ramificações é maior.
c) sua solubilidade no petróleo é maior.
d) as forças intermoleculares são mais intensas.
e) a cadeia carbônica é mais difícil de ser quebrada.
Questão 4 (ENEM 2018)
Tensoativos são compostos orgânicos que possuem comportamento anfifílico, isto é, possuem duas regiões, uma hidrofóbica e outra hidrofílica. O principal tensoativo aniônico sintético surgiu na década de 1940 e teve grande aceitação no mercado de detergentes em razão do melhor desempenho comparado ao do sabão. No entanto, o uso desse produto provocou grandes problemas ambientais, dentre eles a resistência à degradação biológica, por causa dos diversos carbonos terciários na cadeia que compõe a porção hidrofóbica desse tensoativo aniônico. As ramificações na cadeia dificultam sua degradação, levando à persistência no meio ambiente por longos períodos. Isso levou a sua substituição na maioria dos países por tensoativos biodegradáveis, ou seja, com cadeias alquílicas lineares.
PENTEADO, J. C. P.; EL SEOUD, O. A.; CARVALHO, L. R. F. [ … ]:uma abordagem ambiental e analítica. Química Nova, n. 5, 2006 (adaptado).
Qual a fórmula estrutural do tensoativo persistente no ambiente mencionado no texto?
a)

b)
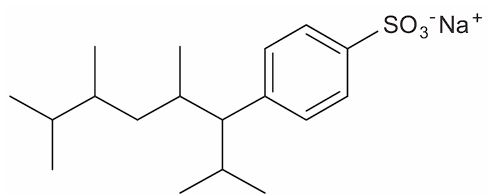
c)
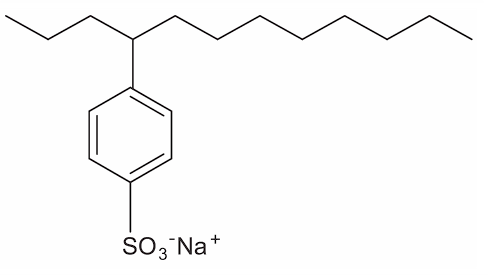
d)
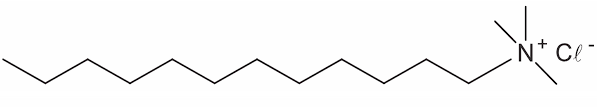
e)
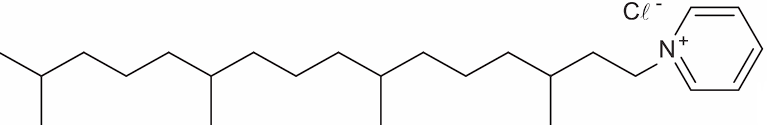
Questão 5 (ENEM 2017)
Na Idade Média, para elaborar preparados a partir de plantas produtoras de óleos essenciais, as coletas das espécies eram realizadas ao raiar do dia. Naquela época, essa prática era fundamentada misticamente pelo efeito mágico dos raios lunares, que seria anulado pela emissão dos raios solares. Com a evolução da ciência, foi comprovado que a coleta de algumas espécies ao raiar do dia garante a obtenção de material com maiores quantidades de óleos essenciais.
A explicação científica que justifica essa prática se baseia na
a) volatilização das substâncias de interesse.
b) polimerização dos óleos catalisada pela radiação solar.
c) solubilização das substâncias de interesse pelo orvalho.
d) oxidação do óleo pelo oxigênio produzido na fotossíntese.
e) liberação das moléculas de óleo durante o processo de fotossíntese.
Questão 6 (ENEM 2017)
Partículas microscópicas existentes na atmosfera funcionam como núcleos de condensação de vapor de água que, sob condições adequadas de temperatura e pressão, propiciam a formação das nuvens e consequentemente das chuvas. No ar atmosférico, tais partículas são formadas pela reação de ácidos (HX) com a base NH3, de forma natural ou antropogênica, dando origem a sais de amônio (NH4X), de acordo com a equação química genérica:
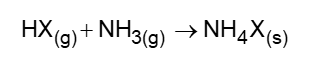
FELIX. E. P.; CARDOSO, A. A. Fatores ambientais que afetam a precipitação úmida. Química Nova na Escola, n. 21, maio 2005 (adaptado).
A fixação de moléculas de vapor de água pelos núcleos de condensação ocorre por
a) ligações iônicas.
b) interações dipolo-dipolo.
c) interações dipolo-dipolo induzido.
d) interações íon-dipolo.
e) ligações covalentes.
Questão 7 (ENEM 2016)
Os tensoativos são compostos capazes de interagir com substâncias polares e apolares. A parte iônica dos tensoativos interage com substâncias polares, e a parte lipofílica interage com as apolares. A estrutura orgânica de um tensoativo pede ser representada por:
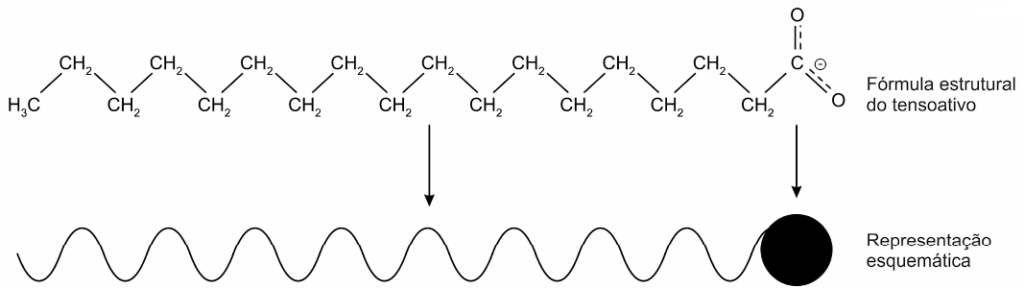
Ao adicionar um tensoativo sobre a água, suas moléculas formam um arranjo ordenado.
Esse arranjo é representado esquematicamente por:
a)
b)
c)

d)
e)
Questão 8 (ENEM 2016)
O carvão ativado é um material que possui elevado teor de carbono, sendo muito utilizado para a remoção de compostos orgânicos voláteis do meio, como o benzeno. Para a remoção desses compostos, utiliza-se a adsorção. Esse fenômeno ocorre por meio de interações do tipo intermoleculares entre a superfície do carvão (adsorvente) e o benzeno (adsorvato, substância adsorvida).
No caso apresentado, entre o adsorvente e a substância adsorvida ocorre a formação de:
a) Ligações dissulfeto.
b) Ligações covalentes.
c) Ligações de hidrogênio.
d) Interações dipolo induzido-dipolo induzido.
e) Interações dipolo permanente-dipolo permanente.
Questão 9 (ENEM 2016)
Em sua formulação, o sprayde pimenta contém porcentagens variadas de oleorresina de Capsicum, cujo principio ativo é a capsaicina, e um solvente (um álcool como etanol ou isopropanol). Em contato com os olhos, pele ou vias respiratórias, a capsaicina causa um efeito inflamatório que gera uma sensação de dor e ardor, levando à cegueira temporária. O processo é desencadeado pela liberação de neuropeptídios das terminações nervosas.
Como funciona o gás de pimenta.Disponível em: http://pessoas.hsw.uol.com.br.
Quando uma pessoa é atingida com o spray de pimenta nos olhos ou na pele, a lavagem da região atingida com água é ineficaz porque a
a) reação entre etanol e água libera calor, intensificando o ardor.
b) solubilidade do princípio ativo em água é muito baixa, dificultando a sua remoção.
c) permeabilidade da água na pele é muito alta, não permitindo a remoção do princípio ativo.
d) solubilização do óleo em água causa um maior espalhamento além das áreas atingidas.
e) ardência faz evaporar rapidamente a água, não permitindo que haja contato entre o óleo e o solvente.
Questão 10 (ENEM 2015)
Pesticidas são substâncias utilizadas para promover o controle de pragas. No entanto, após sua aplicação em ambientes abertos, alguns pesticidas organoclorados são arrastados pela água até lagos e rios e, ao passar pelas guelras dos peixes, podem difundir-se para seus tecidos lipídicos e lá se acumularem.
A característica desses compostos, responsável pelo processo descrito no texto, é o(a)
a) baixa polaridade.
b) baixa massa molecular.
c) ocorrência de halogênios.
d) tamanho pequeno das moléculas.
e) presença de hidroxilas nas cadeias.
Gabarito
1 [B] 2 [D] 3 [D] 4 [B] 5 [A] 6 [D] 7 [C] 8 [D] 9 [B] 10 [A]



