Sejam bem-vindos ao nosso blog sobre as propriedades coligativas! Se você já estudou química ou está cursando alguma disciplina nessa área, provavelmente já ouviu falar desse assunto. As propriedades coligativas são fenômenos que ocorrem em soluções químicas, e que dependem exclusivamente do número de partículas dispersas na solução, independentemente da natureza dessas partículas.
São quatro as propriedades coligativas: pressão osmótica, elevação do ponto de ebulição, abaixamento do ponto de congelamento e tonoscopia (ou abaixamento da pressão de vapor). Essas propriedades são extremamente importantes em diversos processos químicos e bioquímicos, como a osmorregulação em células, a preparação de alimentos e medicamentos, além de serem fundamentais em muitos processos industriais.
Neste blog, você encontrará informações detalhadas sobre cada uma das propriedades coligativas, suas fórmulas, aplicações práticas e exercícios resolvidos. Esperamos que este seja um recurso útil para ajudá-lo a compreender melhor esse fascinante tema da química!
Para estudar eficientemente as propriedades coligativas, é importante seguir um roteiro organizado que aborde todos os aspectos do assunto. A seguir, apresento um roteiro sugerido:
- Revisão dos conceitos básicos de soluções e concentração: Antes de começar a estudar as propriedades coligativas, é importante revisar os conceitos básicos de soluções e concentração, como solubilidade, concentração comum, concentração em mol/L, fração molar e porcentagem em massa. Esses conceitos são essenciais para entender as propriedades coligativas.
- Estudo de cada propriedade coligativa: O próximo passo é estudar cada uma das propriedades coligativas: pressão osmótica, elevação do ponto de ebulição, abaixamento do ponto de congelamento e tonoscopia (ou abaixamento da pressão de vapor). É importante entender os conceitos teóricos, as equações matemáticas e as aplicações práticas de cada propriedade.
- Exercícios resolvidos: Para fixar o conteúdo, é importante fazer exercícios resolvidos de cada propriedade coligativa, buscando entender como aplicar as equações matemáticas e como interpretar os resultados obtidos.
- Exercícios propostos: Depois de ter entendido bem os conceitos teóricos e praticado com exercícios resolvidos, é importante fazer exercícios propostos, que envolvam situações mais complexas e desafiadoras. Esses exercícios ajudarão a desenvolver a capacidade de aplicar os conceitos teóricos em diferentes contextos.
- Revisão geral: Por fim, é importante fazer uma revisão geral de todo o conteúdo estudado, buscando identificar pontos que ainda não foram compreendidos completamente e reforçando os conceitos mais importantes. É importante lembrar que as propriedades coligativas são um assunto interdisciplinar, que envolve conceitos de química, física e matemática, por isso, é importante integrar os conhecimentos de cada uma dessas áreas para uma compreensão mais completa.
Vamos ver alguns termos?
Pressão de vapor:
A pressão de vapor é uma das propriedades coligativas das soluções, que se refere à pressão exercida pelos vapores em equilíbrio com a solução líquida em um sistema fechado. Essa pressão é determinada pelo número de partículas de soluto presentes na solução e afeta diretamente a taxa de evaporação e condensação do solvente.
Quando uma substância líquida é colocada em um recipiente fechado, algumas de suas moléculas podem escapar da superfície e se tornarem vapor. Quando o número de moléculas de vapor aumenta, a pressão de vapor também aumenta. Em uma solução líquida, a presença do soluto afeta o número de moléculas de solvente que podem escapar para a fase gasosa, reduzindo assim a pressão de vapor em relação à pressão de vapor do solvente puro.
Por exemplo, se compararmos a pressão de vapor de um copo de água pura e a pressão de vapor de um copo de água salgada, veremos que a água salgada tem uma pressão de vapor menor do que a água pura. Isso ocorre porque o sal dissolvido na água impede que algumas moléculas de água escapem para a fase gasosa, o que reduz a pressão de vapor da solução.
Outro exemplo é a adição de álcool em água. Quando adicionamos álcool à água, a pressão de vapor da solução resultante é menor do que a pressão de vapor da água pura. Isso ocorre porque as moléculas de álcool têm uma atração intermolecular mais fraca do que as moléculas de água, e assim, permitem que mais moléculas de água escapem para a fase gasosa em comparação com a água pura.
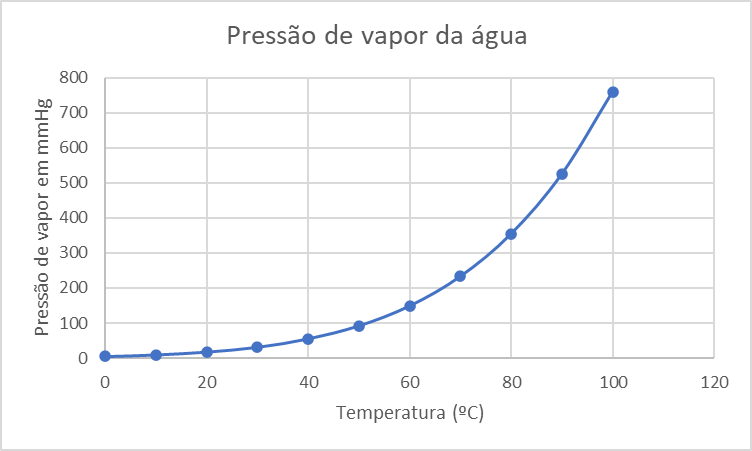
Segue abaixo a tabela de pressão de vapor da água em função da temperatura:
| Temperatura (°C) | Pressão de vapor (mmHg) |
|---|---|
| 0 | 4,58 |
| 10 | 9,21 |
| 20 | 17,54 |
| 30 | 31,16 |
| 40 | 55,30 |
| 50 | 92,50 |
| 60 | 149,40 |
| 70 | 233,70 |
| 80 | 355,10 |
| 90 | 525,80 |
| 100 | 760,00 |
Essa tabela representa a pressão de vapor da água em equilíbrio com seu estado líquido em diferentes temperaturas. A pressão de vapor é a pressão exercida pelo vapor de uma substância em equilíbrio com sua fase líquida em um recipiente fechado. A tabela é útil para diversas aplicações, como no cálculo da umidade relativa do ar e na determinação do ponto de ebulição de uma solução líquida. Abaixo segue o gráfico da pressão de vapor x a temperatura em ºC.
Tonoscopia:
Tonoscopia, também conhecida como tonometria, é um fenômeno que ocorre quando um soluto não volátil é dissolvido em um líquido (solvente), resultando na diminuição da pressão máxima de vapor desse líquido. A pressão máxima de vapor é a pressão exercida pelos vapores do líquido em equilíbrio dinâmico com o líquido e é influenciada por fatores como temperatura e natureza do líquido. Quanto mais volátil o líquido, maior sua pressão de vapor. A pressão de vapor depende apenas da natureza química da substância e não da quantidade. Líquidos mais voláteis, como éter comum, álcool etílico e acetona, evaporam mais intensamente e possuem maior pressão de vapor.
Ebulioscopia:
Ebulioscopia, também conhecida como ebuliometria, é um fenômeno que contribui para o aumento da temperatura de ebulição de um líquido durante o processo de ebulição quando um soluto não volátil é dissolvido nele. Por exemplo, quando adicionamos açúcar na água que está prestes a entrar em ebulição, a temperatura de ebulição do líquido aumenta.
Crioscopia:
A crioscopia é o método de análise que mede a diminuição do ponto de congelamento de um solvente puro em relação a uma solução desse solvente com um soluto não volátil. A técnica é amplamente utilizada para a determinação da massa molar de solutos desconhecidos em soluções.
Um exemplo prático de crioscopia é a determinação da massa molar de um soluto em solução, como o cloreto de sódio em água. Ao adicionar sal à água, a pressão de vapor diminui e o ponto de congelamento da solução se torna menor do que o da água pura. A partir da medida da diminuição do ponto de congelamento, a massa molar do soluto pode ser calculada usando a equação de Raoult ou a equação de van’t Hoff.
1. (Fcmscsp 2023)
A figura apresenta três béqueres contendo, separadamente, volumes iguais de água destilada (líquido 1), solução aquosa de fluoreto de sódio (NaF) 1 mol/L (líquido 2) e solução aquosa de glicose (C6H12O6) 1 mol/L (líquido 3).
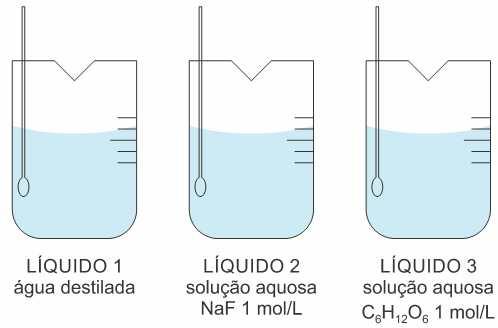
Considere que os três líquidos tenham sido mantidos à mesma temperatura de 60°C. Nessa condição, as pressões de vapor desses líquidos (PV1, PV2 e PV3) estão relacionadas pela expressão matemática:
a) PV1 > PV3 > PV2
b) PV1 > PV2 = PV3
c) PV2 > PV3 > PV1
d) PV2 > PV1 > PV3
e) PV1 > PV2 < PV3
2. (Ufsc 2023)
As propriedades coligativas estão presentes no nosso dia a dia e explicam diversos fenômenos que observamos rotineiramente.
Sobre os fenômenos relacionados às propriedades coligativas, é correto afirmar que:
01) um dos processos aplicáveis à dessalinização da água do mar para produzir água potável é a decantação, na qual a diferença de pressão força a passagem de solvente do meio mais concentrado para o meio menos concentrado.
02) em uma estrada de Urubici impactada por uma nevasca, pode-se usar sal para derreter a neve, já que isso promoverá o abaixamento da temperatura de fusão da água.
04) a água usada para cozinhar um macarrão ferve em temperaturas menores se a ela for adicionado sal de cozinha, já que isso promove a diminuição da pressão máxima de vapor.
08) a crioscopia consiste em um aumento na pressão osmótica ocasionada pela adição de um solvente à solução.
16) a adição de quantidades idênticas (em mol) de cloreto de sódio ou de cloreto de cálcio em um solvente resultará em efeitos idênticos sobre a pressão máxima de vapor do solvente.
32) a pressão máxima de vapor da água em um copo contendo café adoçado com 10 g de sacarose será menor do que em um copo idêntico contendo café não adoçado.
3. (Uece 2023)
Nos carrinhos de venda, os picolés estão contidos em uma caixa que está mergulhada em uma solução de sal de cozinha para evitar o seu derretimento. A propriedade que explica a manutenção dos picolés no estado sólido é a
a) ebulioscopia.
b) osmometria.
c) tonoscopia.
d) crioscopia.
4. (Ueg 2022)
Na tabela a seguir estão apresentados os valores de pressão de vapor, a 20 °C, e das respectivas temperaturas de ebulição, quando a pressão atmosférica é 101,325 kPa, de quatro solventes líquidos, em ordem alfabética:
| Solvente | Pressão de vapor / kPa | Temperatura de ebulição / °C |
| Ciclopentano | 45,0 | 49,2 |
| Éter etílico | 58,9 | 34,6 |
| Hexano | 17,0 | 68,7 |
| Pentano | 53,3 | 36,0 |
Analisando as propriedades físico-químicas desses quatro solventes, apresentadas na tabela, constata-se que:
a) quanto maior a pressão de vapor do solvente, mais volátil ele é, e mais baixa é sua temperatura de ebulição.
b) quanto maior a pressão de vapor do solvente, menos volátil ele é, e mais baixa é sua temperatura de ebulição.
c) quanto menor a pressão de vapor do solvente, mais volátil ele é, e mais baixa é sua temperatura de ebulição.
d) quanto menor a pressão de vapor do solvente, mais volátil ele é, e mais alta é sua temperatura de ebulição.
e) quanto maior a pressão de vapor do solvente, mais volátil ele é, e mais alta é sua temperatura de ebulição.
5. (Famerp 2022)
O éter etílico (C4H10O), o hexano (C6H14) o etanol (C6H5OH) são solventes bastante utilizados nos laboratórios de química orgânica. A tabela apresenta a densidade e a temperatura de ebulição desses solventes e da água (H2O).
| Substância | Água (18 g/mol) | Éter etílico (74 g/mol) | Hexano (86 g/mol) | Etanol (46 g/mol) |
| Densidade (g/mL) | 1,0 | 0,7 | 0,7 | 0,8 |
| Temperatura de ebulição (°C) | 100 | 35 | 69 | 78 |
a) Qual a interação intermolecular presente no hexano? Considerando os tipos de interações intermoleculares, qual dos solventes orgânicos apresenta maior solubilidade em água?
b) Organize as substâncias da tabela em ordem crescente de pressão de vapor. Considerando uma mistura contendo volumes iguais de hexano e etanol, calcule o valor da relação:
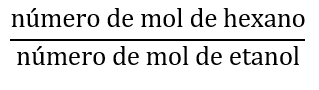
6. (Ita 2022)
Considere as seguintes afirmações sobre equilíbrio de fases e propriedades coligativas.
I. A adição de um soluto não volátil a um solvente puro, em uma dada temperatura constante, sempre provoca uma diminuição na pressão de vapor.
II. A pressão de vapor de uma solução formada por dois líquidos voláteis é sempre menor que a pressão de vapor dos líquidos puros a uma mesma temperatura.
III. O valor absoluto do abaixamento no ponto de congelamento de uma solução é menor se o soluto dimeriza parcialmente no solvente, comparado ao sistema nas mesmas condições em que não há a dimerização do soluto.
IV. A pressão osmótica é a pressão exercida pelas moléculas de soluto numa membrana semipermeável.
V. Uma mistura formada por duas substâncias nunca solidifica inteiramente em uma única temperatura.
Assinale a opção que contém a(s) afirmação(ões) CORRETA(S):
a) Apenas I, III
b) Apenas I, II e V
c) Apenas II, III, IV e V
d) Apenas III, IV e V
e) Todas
7. (Ufjf-pism 2 2022)
Uma professora de química realizou uma experiência com seus estudantes para demonstrar o comportamento da matéria quando se alteram algumas condições como: pressão, temperatura e volume. Ela sugou com uma seringa 2mL de água a 50°C, depois tampou a entrada da seringa e puxou o êmbolo como se fosse retirá-lo, no sentido contrário da entrada. Ao fazer esse movimento de puxar o êmbolo, bolhas se formaram no interior da seringa.
Esse fato pode ser explicado, pois:
a) a pressão no interior da seringa é maior, o que favorece a decomposição da água em H2(g) e O2(g).
b) a pressão no interior da seringa é maior, o que possibilita o aumento de temperatura da água.
c) a pressão no interior da seringa é menor, o que permite a água entrar em ebulição.
d) aumenta-se a temperatura no interior da seringa e o oxigênio dissolvido na água forma bolhas.
e) aumenta-se o volume no interior da seringa e consequentemente a temperatura aumenta no interior da seringa.
8. (Unesp 2022)
Todas as soluções aquosas cujos solutos estão indicados nas alternativas são de mesma concentração em mol/L. A solução que deve apresentar menor temperatura de congelamento é a de
a) C6H12O6
b) K2SO4
c) NH4Cl
d) CuSO4
e) CH3COOH
Gabarito das questões:
Questão 1: [A]
Questão 2: 02 + 32 = 34
Questão 3: [D]
Questão 4: [A]
Questão 5:
a) Interação intermolecular presente no hexano (molécula apolar): dipolo induzido (dipolo instantâneo ou dispersões de London).
Solvente orgânico com maior solubilidade em água: etanol, pois faz intensas ligações de hidrogênio com a água.
b) Quanto maior a temperatura de ebulição, menor a pressão de vapor da substância e vice-versa. Organizando a tabela fornecida no texto da maior temperatura de ebulição (menor pressão de vapor) para a menor temperatura de ebulição (maior pressão de vapor), vem a ordem crescente de pressão de vapor: Água < Etanol < Hexano < Éter etílico.
Questão 6: [A]
Questão 7: [C]
Questão 8: [B]
Sugestão de vídeos:



