Na química, as ligações covalentes desempenham um papel fundamental na formação de moléculas. Elas são responsáveis por unir átomos e permitir o compartilhamento de elétrons, criando estruturas estáveis e diversas substâncias que encontramos no nosso dia a dia. Neste artigo, vamos explorar o conceito de ligações covalentes, entender como elas ocorrem e mergulhar nas maravilhas desse tipo de ligação química.
O que são ligações covalentes?
As ligações covalentes ocorrem quando dois ou mais átomos compartilham elétrons em sua camada de valência. Diferente das ligações iônicas, onde há transferência completa de elétrons, as ligações covalentes envolvem um compartilhamento mútuo de elétrons entre os átomos envolvidos. Esse compartilhamento cria uma força atrativa que mantém os átomos unidos na molécula.
Compartilhamento de elétrons:
No compartilhamento de elétrons, cada átomo contribui com um ou mais elétrons para a formação de uma ligação. O objetivo é alcançar a estabilidade, preenchendo a camada de valência dos átomos envolvidos. Os elétrons compartilhados são atraídos pelos núcleos dos átomos, mantendo-os unidos e formando a ligação covalente.
Tipos de ligações covalentes:
Existem diferentes tipos de ligações covalentes, dependendo do número de elétrons compartilhados. Na ligação covalente simples, dois átomos compartilham um par de elétrons. Na ligação covalente dupla, dois pares de elétrons são compartilhados, enquanto na ligação covalente tripla, três pares de elétrons são compartilhados. Essas diferentes formas de compartilhamento de elétrons resultam em estruturas moleculares únicas e propriedades específicas.
Propriedades das substâncias covalentes:
As substâncias covalentes geralmente apresentam baixo ponto de fusão e ebulição, devido à força de atração relativamente fraca entre as moléculas. Além disso, elas tendem a ser insolúveis em solventes polares, mas solúveis em solventes não polares. A natureza das ligações covalentes também influencia outras propriedades, como a condutividade elétrica, que geralmente é baixa ou nula em substâncias covalentes moleculares.
Exemplos e aplicações:
Ligações covalentes estão presentes em uma infinidade de substâncias ao nosso redor. A água, por exemplo, é um exemplo clássico de uma molécula formada por ligações covalentes. As ligações covalentes são cruciais na formação de moléculas biológicas, como proteínas, carboidratos e ácidos nucleicos, que desempenham papéis vitais em organismos vivos.
Além disso, as ligações covalentes são fundamentais na química farmacêutica, pois permitem a criação de moléculas com propriedades específicas para o desenvolvimento de medicamentos. Também são essenciais na indústria química, sendo usadas na fabricação de plásticos, fibras sintéticas, solventes e uma infinidade de produtos químicos.
Esse vídeo é o primeiro de uma série que irei apresentar a ligação química e suas características. Segue como introdução para o entendimento inicial das ligações químicas.
Ligação química na respiração:
Explore o simulador de geometria molecular disponível no website phet.colorado.edu. Nessa ferramenta interativa, é possível investigar o impacto da repulsão entre pares de elétrons de maneira dinâmica. Recomendo que faça um teste e crie uma tabela contendo informações sobre o número de ligantes e pares de elétrons, juntamente com suas geometrias correspondentes. Isso permitirá uma análise mais completa e estruturada dos dados obtidos. Para isso acesso o item modelo.
Veja uma tabela que pode ser obtida da simulação com as geometrias dos respectivos pares de elétrons:
Material da University of Colorado Bouder Phet interactive Simulator: https://phet.colorado.edu/pt_BR/simulations/molecule-shapes/about

Pegadinha da UNESP! (Unesp 2022)
Substâncias compostas podem ser de três tipos:
- Tipo 1: substância composta que apresenta apenas ligações covalentes.
- Tipo 2: substância composta que apresenta apenas ligações iônicas.
- Tipo 3: substância composta que apresenta ligações iônicas e covalentes.
São exemplos de substâncias compostas dos tipos 1, 2 e 3, respectivamente,
a) HCCl3, CaCl2 e NH4Cl
b) NH4Cl, CaCl2 e HCCl3
c) CaCl2, NH4Cl e HCCl3
d) HCCl3, NH4Cl e CaCl2
e) NH4Cl, HCCl3 e CaCl2
Resolução no vídeo:
Vamos ver exemplos de moléculas, molécula da água (H2O):
Moléculas de fosfina (PH3) e amônia (NH3):
Molécula do dióxido de enxofre (SO2):
Questões de vestibular
1.(Unisc 2023)
As substâncias amônia, metano, gás carbônico e água, todas elas com exclusivas ligações covalentes entre seus átomos, apresentam, respectivamente, geometrias
a) angular, tetraédrica, trigonal angular e linear.
b) trigonal angular, piramidal, trigonal angular e linear.
c) trigonal angular, tetraédrica, linear e angular.
d) trigonal planar, piramidal, trigonal angular e linear.
e) trigonal planar, piramidal, linear e trigonal angular.
2. (Pucrs Medicina 2023)
Considere as propriedades físico-químicas dos compostos X, Y e Z apresentadas no quadro a seguir.

Com base no quadro, a natureza da ligação química mais provável para os compostos X, Y e Z é, respectivamente, __________, __________ e __________.
a) ligação covalente – ligação iônica – ligação iônica
b) ligação metálica – ligação covalente – ligação iônica
c) ligação iônica – ligação metálica – ligação covalente
d) ligação covalente – ligação iônica – ligação metálica
3. (Fatec 2023)
Platão (428 a.C. – 347 a.C.), filósofo e matemático grego, defendia uma teoria segundo a qual a natureza era composta por sólidos minúsculos, conhecidos hoje pelo nome sólidos platônicos.
Um sólido platônico, na matemática, é descrito como um poliedro convexo no qual
– todas as faces são formadas por polígonos regulares e congruentes entre si;
– o mesmo número de arestas encontra-se em todos os vértices; e
– os ângulos poliédricos são congruentes entre si.
Muitos séculos depois, os químicos estabeleceram teorias que lhes permitiram a criação de modelos de geometrias moleculares, algumas das quais estão mostradas na imagem.

Dadas as substâncias: amônia, NH3; trióxido de enxofre, SO3; água, H2O; metano, CH4 e dióxido de carbono, CO2.
Assinale a alternativa que apresenta a molécula com geometria trigonal plana.
Dados números atômicos
H = 1
C = 6
N = 7
O = 8
S = 16
a) SO3
b) NH3
c) H2O
d) CH4
e) CO2
4. (Uea 2023)
Em um aterro sanitário, o gás metano (CH4) gerado pela decomposição de resíduos orgânicos pode ser captado e direcionado para um “flare” (queimador de biogás), sofrendo uma reação química, conforme a ilustração.
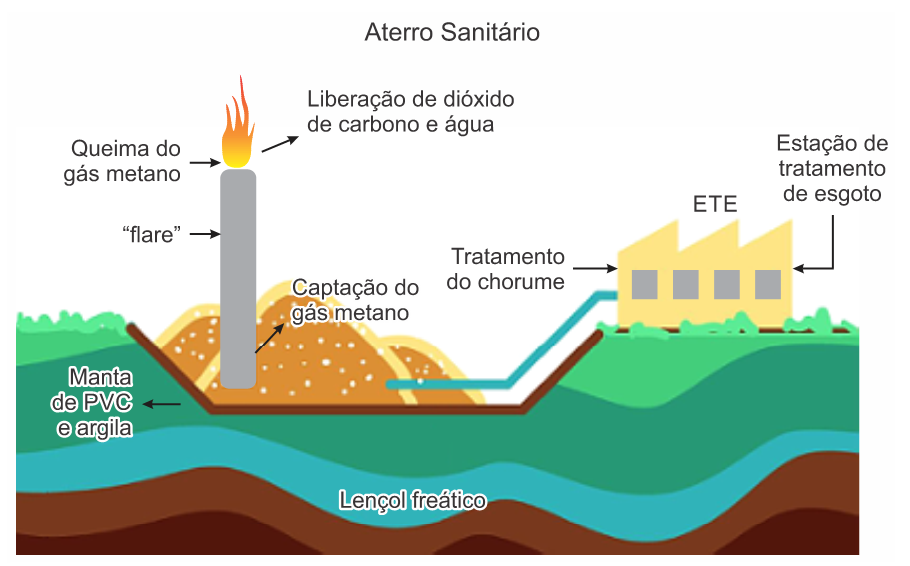
A geometria molecular do gás metano e a do gás dióxido de carbono são, respectivamente,
a) piramidal e angular.
b) tetraédrica e piramidal.
c) linear e linear.
d) angular e angular.
e) tetraédrica e linear.
5. (Upe-ssa 1 2022)
Stanley Miller (1930-2007) realizou, na Universidade de Chicago, em 1953, experiências simulando as condições da atmosfera secundária terrestre, buscando comprovar a hipótese dos coacervados, de Oparin e Haldane. A figura apresenta a montagem experimental.

No local onde ocorre a descarga de centelha elétrica, foram colocados quatro gases, que o cientista acreditava compor a atmosfera:
I. Vapor de uma substância encontrada na forma líquida à temperatura ambiente, de geometria angular e polar.
II. Substância gasosa apolar, com ligações duplas e geometria linear.
III. Substância gasosa polar, de geometria piramidal e formada apenas por ligações simples.
IV. Substância gasosa apolar, de geometria tetraédrica e formada apenas por ligações simples.
Dados: H (grupo 1); C (grupo 14); N (grupo 15); O (grupo 16).
As substâncias I, II, III e IV são, respectivamente:
a) etanol, gás carbônico, sulfeto de hidrogênio e metano.
b) água, gás carbônico, trifluoreto de boro e sulfeto de hidrogênio.
c) gás cloro, metano, amônia e tricloreto de boro.
d) metano, água, etanol e gás cloro.
e) água, gás carbônico, amônia e metano.
6. (Espcex (Aman) 2017)
Compostos contendo enxofre estão presentes, em certo grau, em atmosferas naturais não poluídas, cuja origem pode ser: decomposição de matéria orgânica por bactérias, incêndio de florestas, gases vulcânicos etc. No entanto, em ambientes urbanos e industriais, como resultado da atividade humana, as concentrações desses compostos são altas. Dentre os compostos de enxofre, o dióxido de enxofre (SO2) é considerado o mais prejudicial à saúde, especialmente para pessoas com dificuldade respiratória.
Adaptado de BROWN, T.L. et al, Química: a Ciência Central. 9ª ed, Ed. Pearson, São Paulo, 2007.
Em relação ao composto SO2 e sua estrutura molecular, pode-se afirmar que se trata de um composto que apresenta
Dado: número atômico S = 16 e O = 8.
a) ligações covalentes polares e estrutura com geometria espacial angular.
b) ligações covalentes apolares e estrutura com geometria espacial linear.
c) ligações iônicas polares e estrutura com geometria espacial trigonal plana.
d) ligações covalentes apolares e estrutura com geometria espacial piramidal.
e) ligações iônicas polares e estrutura com geometria espacial linear.
Gabarito
1. [C]
2. [C]
3. [A]
4. [E]
5. [E]
6. [A]
TESTE – Questões formativas (1/3)
Questão 1 – Ligação Química – parte 2/2
O consumo cada vez maior de combustíveis fósseis tem levado a um aumento considerável da concentração de dióxido de carbono na atmosfera, o que acarreta diversos problemas, dentre eles o efeito estufa.
Com relação à molécula de dióxido de carbono, é correto afirmar que:
a) é apolar e apresenta ligações covalentes apolares.
b) é polar e apresenta ligações covalentes polares.
c) os dois átomos de oxigênio estão ligados entre si por meio de uma ligação covalente apolar.
d) é apolar e apresenta ligações covalentes polares.
e) apresenta quatro ligações covalentes apolares.
Questão 2 – Ligação Química – parte 2/2
O tipo de ligação que une os átomos nos compostos Al, Al2O3 e H2O é, respectivamente:
a) metálica, covalente e iônica.
b) iônica, covalente e iônica.
c) metálica, iônica e covalente.
d) covalente, iônica e covalente.
Questão 3 – Ligação Química – parte 2/2
As propriedades específicas da água a tornam uma substância química indispensável à vida na Terra. Essas propriedades decorrem das características de sua molécula H2O, na qual os dois átomos de hidrogênio estão unidos ao átomo de oxigênio por ligações
a) iônicas, resultando em um arranjo linear e apolar.
b) iônicas, resultando em um arranjo angular e polar.
c) covalentes, resultando em um arranjo linear e apolar.
d) covalentes, resultando em um arranjo angular e apolar.
e) covalentes, resultando em um arranjo angular e polar.
Questão 4 – Ligação Química – parte 2/2
Um dos ácidos mais relevantes na indústria química é o ácido perclórico (HClO4), que é utilizado na fabricação de explosivos, por ser um forte oxidante; na produção de herbicidas; em exames de precipitação seletiva de mucoproteínas etc. Em relação a sua fórmula estrutural, é sabido que ela apresenta
a) 1 ligação coordenada e 3 ligações covalentes simples.
b) 1 ligação covalente simples e 3 ligações coordenadas.
c) 2 ligações covalentes simples e 3 ligações coordenadas.
d) 2 ligações coordenadas e 3 ligações covalentes simples.
Respostas:
Digite suas respostas no link:



